胃肠间质瘤(gastrointestinal stromal tumor,GIST)大体病理特点多为规则、质软的实质性肿块。虽然有部分GIST呈囊性变,但极少GIST发现时即为显著囊性变,实性部分仅占极低比例。这类呈显著囊性变的GIST术前诊断较为困难,而且也难以使用现行的危险度分级标准评估其术后复发风险及恶性程度。
[病例摘要]
患者,女性,70岁,于2010年6月10日因“触及左上腹肿块1年”就诊于当地医院,查B超提示腹腔巨大占位,遂来我院门诊就诊,查腹盆腔增强CT示肝胃间巨大囊实性肿块影,倾向恶性肿瘤,考虑胃壁来源可能性大。
一、既往史及家族史
既往体健;否认药物过敏史;父母健在,家族中无类似病史。
二、体格检查
生命体征平稳,皮肤黏膜无黄染、无苍白。左上腹隆起,未见胃肠型及蠕动波。腹软,无压痛、反跳痛,左上腹触及巨大肿块,约20cm×15cm,质硬,表面光滑,边缘不规则,较固定;肝脾肋下未及。移动性浊音(-),肠鸣音正常。直肠指诊:肠壁光滑,未及明显肿块。
三、辅助检查
腹盆腔增强CT:肝胃之间巨大囊实性肿块影,形态不规则,边缘可见钙化,内见斑片状较高密度影,大小约13.7cm×15.2cm,增强后强化不明显,与胃小弯侧部分胃壁分界欠清,胃受压移位明显,肝脏表面光滑,各叶比例均匀,肝实质密度未见异常,动态增强后未见异常强化灶,肝内血管分布均匀,走向自然,未见狭窄或充盈缺损;脾脏未见肿大,密度均匀;胆囊壁光滑,未见局限性增厚,胆管未见扩张;胰腺及双侧肾脏无殊;后腹膜未见肿大淋巴结;腹腔内无积液(图1)。
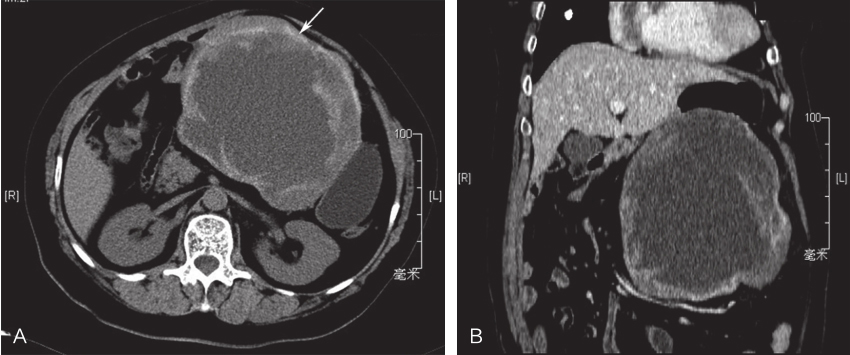
图1腹盆腔CT示肝胃间巨大囊实性肿块
A.水平位;B.冠状位
胃镜:可见胃窦部小弯侧巨大黏膜下隆起。
四、初步诊断
腹腔巨大囊实性占位
[治疗过程]
一、病例分析
患者为老年女性,以“触及左上腹肿块1年”就诊,CT提示肝胃之间巨大占位,胃镜见胃窦部小弯侧巨大黏膜下隆起,建议先行内镜下穿刺活检明确诊断,但患者肿块显著囊性变,穿刺可能无法取得足够组织行病理检测。在细致评估患者术前影像,并和患者及家属反复沟通后,决定行剖腹探查术。
二、治疗方案
于2010年6月13日行“胃巨大肿瘤切除术”,术中见:胃窦部小弯侧直径15cm巨大肿瘤,质硬,界清,包膜完整,未侵犯周围脏器,胃周淋巴结未见明显肿大。分离肿块与周围大网膜等组织粘连,于胃小弯侧距肿瘤2cm处钳闭器钳闭小弯侧,完整切除肿瘤,残端包埋缝合满意,无张力,血供好,检查术野无出血,清点器械敷料无误,逐层缝合切口。
三、术后病理及基因检测
术后病理:胃肠间质瘤,上皮样细胞为主型,细胞丰富密集,明显异型,散在少量瘤巨细胞,灶性坏死,核分裂象难见,形态学提示为低度恶性胃肠间质瘤(图2)。
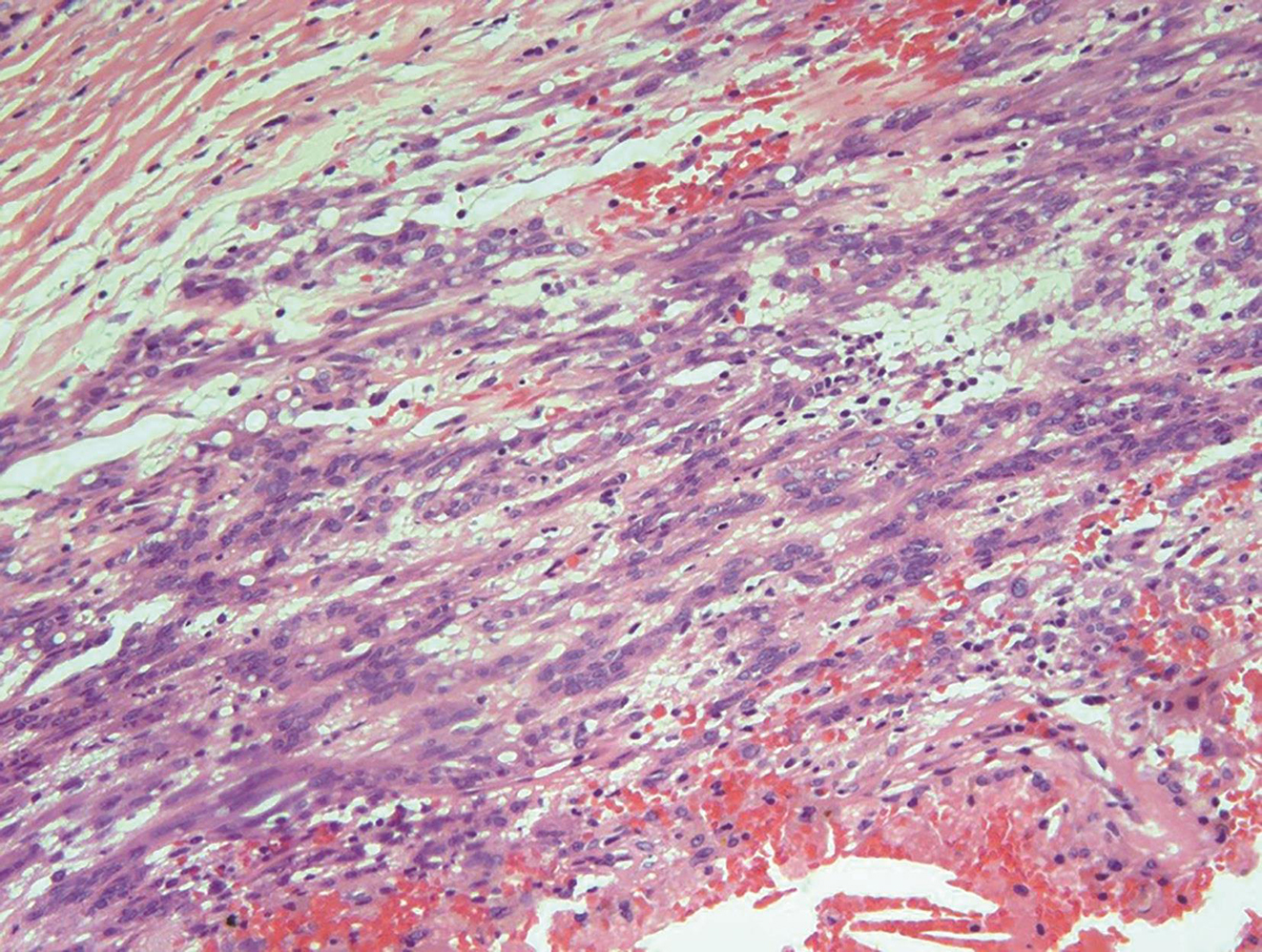
图2术后病理
免疫组织化学染色:CD117(+),CD34(+),DOG-1(+),CK(-),desmin(-),calre(-),CK5/6(-),NES(+),S-100(-),SMA(-),HBME-1(-),Ki-67(Li:1%)。
基因检测:c-KIT基因第11外显子第559位密码子GTT(Val)突变为GAT(Ala);c-KIT基因第9、13、17外显子及PDGFRA基因第12、18外显子无突变。
[预后]
患者于术后第9天恢复出院,术后未服甲磺酸伊马替尼靶向治疗。术后第1年,每3个月复查腹盆腔增强CT;术后1年起,每6个月复查腹盆腔增强CT,截至2018年6月,随访96个月,无明显复发转移征象。
[经验与体会]
一、胃肠间质瘤囊性变的原因
胃肠间质瘤在以下几种情况下可发生囊性变:①原发性的囊性GIST;②恶性GIST的囊性变;③GIST的肝脏或胰腺转移灶;④GIST接受甲磺酸伊马替尼治疗后。恶性GIST囊性变是因为肿瘤生长过快,内部供血不足,导致坏死、液化,通常恶性程度高,边界不清晰,包膜欠完整,可侵犯周围脏器,预后较差;而原发性囊性GIST囊性结构占主体,主要为膨胀性生长,有假包膜,较少侵及周围脏器,预后较好。
二、原发性囊性GIST的诊疗难点
原发性囊性GIST的术前诊断较为困难,仅依靠影像检查易误诊为腹腔其他囊性肿瘤,如淋巴管瘤、胰腺假性囊肿、恶性肿瘤的囊性变等。同时,囊性GIST因实性组织所占比例低,穿刺较难获得足够组织,并且存在致肿瘤破裂扩散的风险。手术目前是唯一既能明确诊断又可进行根治的治疗方式,但囊性GIST实性组织占比低,核分裂常不活跃,术后是否应依据肿瘤大小行靶向治疗亦存在争议。
[专家点评]
GIST是一种典型的实性肿瘤,可出现小灶囊性变。以囊性结构为主的囊性GIST临床少见,其包膜完整,边界清楚,不侵犯周围脏器,囊性结构占肿瘤体积75%以上。有研究认为,这可能是由于外生性生长模式导致乏血供,或因肿瘤与胃肠腔相通(如胃肠道黏膜溃疡致使胃肠液进入瘤腔,随后诱发脓肿样形成),其囊壁厚度相对均匀,恶性生物学行为较少。而GIST囊性变通常发生在恶性GIST、GIST的肝脏等转移灶或接受TKI药物治疗后的病例中,肿瘤恶性程度高,因生长过快导致内部坏死液化而呈囊性变,可侵犯周围脏器,可有肝转移,预后往往较差。
由于囊性GIST一般体积较大,且与周围脏器毗邻关系复杂,术前诊断较为困难,主要依靠影像学检查,但需要与腹腔其他囊性肿瘤,如淋巴管瘤、胰腺假性囊肿等相鉴别。这类影像诊断困难的病例,我们可以参考北京大学肿瘤医院唐磊教授提出的依据血供、肿物黏膜特征与伴发特征的三步法来诊断与鉴别GIST,对于临床诊断与外科评估非常实用。当然,还有一部分病例只有通过手术探查和术后病理才能明确诊断和肿瘤来源。
手术通常采用开腹手术方式,完整切除肿瘤并避免肿瘤破裂是我们应当遵循的原则。病理上,囊性GIST在形态学和免疫组织化学染色方面与实性GIST相似,但核分裂象相对较少,基因突变也较少,原因可能是囊性成分占据使得肿瘤细胞数量不足,或者这可能就是囊性GIST的一个独特特征。
改良NIH危险度分级是目前应用最广泛的评估标准,其中肿瘤大小及核分裂象是最重要的两个指标。然而,对于囊性GIST,肿瘤大小难以客观评估,瘤体的大小未必代表肿瘤实质区的大小,当前的诸多评估标准可能无法对这类肿瘤的预后做出准确的分级判断。不过,从临床实际工作和文献报道中,囊性GIST往往表现为惰性生物学行为,手术完整切除后往往可获得较好预后。对于是否需要服用TKI药物,由于缺少循证医学证据,还有一定的争论。
免责声明
内容来源于人卫知识数字服务体系、人卫inside知识库,其观点不反映优医迈或默沙东观点。 此服务由优医迈与胤迈医药科技(上海)有限公司授权共同提供。
如需转载,请前往用户反馈页面提交说明:https://www.uemeds.cn/personal/feedback
[1] BECHTOLD R E, CHEN M Y, STANTON C A, et al. Cystic changes in hepatic and peritoneal metastases from gastrointestinal stromal tumors treated with Gleevec [J] . Abdominal imaging, 2003, 28 (6) : 808-814.
[2] SUN K K, XU S, CHEN J, et al. Atypical presentation of a gastric stromal tumor masquerading as a giant intraabdominal cyst: A case report [J] . Oncology letters, 2016, 12 (4) : 3018-3020.
[3] WANG L, LIU L, LIU Z, et al. Giant gastrointestinal stromal tumor with predominantly cystic changes: a case report and literature review [J] . World journal of surgical oncology, 2017, 15 (1) : 220.
人卫知识数字服务体系





 Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
