胃肠间质瘤(gastrointestinal stromal tumor,GIST)最常见于消化道(95%),也有少数(5%)原发于腹腔内其他软组织如:大网膜、肠系膜或者后腹膜等,这部分肿瘤被称为胃肠外GIST(extragastrointestinal stromal tumor,EGIST)。临床上发生于盆底区域(包括直肠、直肠阴道隔、阴道后壁、膀胱前后区域、前列腺前后区域、骶前区)的GIST,由于其发病位置特殊,其治疗涉及盆底器官组织功能保护等问题,因此需要引起临床医生的关注。
【病例摘要】
患者,女性,33岁,于2016年4月8日因“发现会阴部肿物1年半”就诊。患者于2014年10月体检发现“左侧阴道内壁囊肿”,无疼痛,无接触性出血,未行治疗。2015年10月时感觉经期阴道左侧坠胀感,行超声检查考虑“左侧前庭大腺囊肿”,予中药治疗,效果不佳。2015年11月自觉肿物增大、向外膨出,伴尿细、排尿不尽感,未见异常分泌物,行妇科超声检查示:阴道壁外口左侧见一囊实性结构,大小约2.3cm×2.1cm×2.3cm,边界清楚,内透声差,可见密集点状回声。2016年2月自觉肿物增大伴疼痛、会阴区红肿,于外院以“前庭大腺囊肿伴感染”收住院,并行抗感染治疗,自觉症状稍缓解。2016年3月于外院行前庭大腺囊肿切除术,术中发现囊实性肿物,以实性成分为主,考虑肿物性质不明确,遂暂停切除术,行囊性成分穿刺吸取血性液体3ml,送细菌培养阴性。术后持续有血性渗出,自觉肿物变大,行抗感染治疗后疼痛稍缓解。行超声引导下经会阴穿刺活检术,病理示:梭形细胞肿瘤,细胞中度异型,核分裂象易见(18 个 /50 HPF),免疫组织化学染色:CD117(+),CD34(+),S-100(-),Ki-67(Li:10%~20%),ER(-),PR(-),考虑胃肠间质瘤(高危)可能性大。穿刺组织基因检测:c-KIT基因11外显子缺失突变(c.1670-1675delGGAAGG.)。术后患者自觉肿块明显增大,疼痛加重。完善盆腔MRI(图1):直肠下段与阴道间见类椭圆形混杂软组织信号影,最大截面约5.7cm×3.7cm,增强扫描见不均匀强化,病变与直肠前壁、阴道后壁均分界不清,邻近组织受压移位;阴道上段梗阻积液。
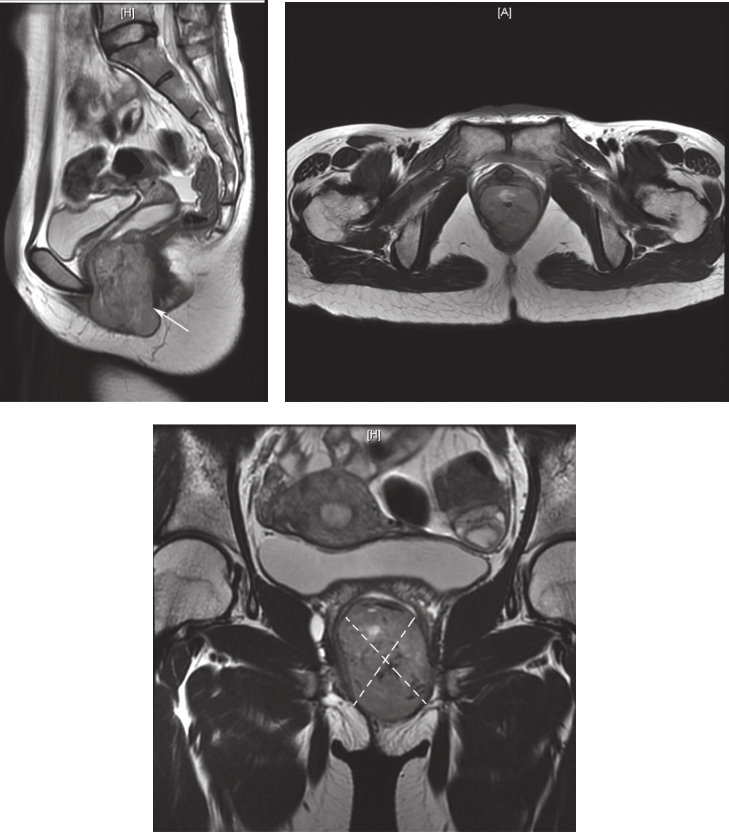
图1 首诊盆腔MRI表现
引自:胃肠间质瘤典型病例诊治与解析.第1版.ISBN:978-7-117-30146-6.主编:陶凯雄 曹 晖
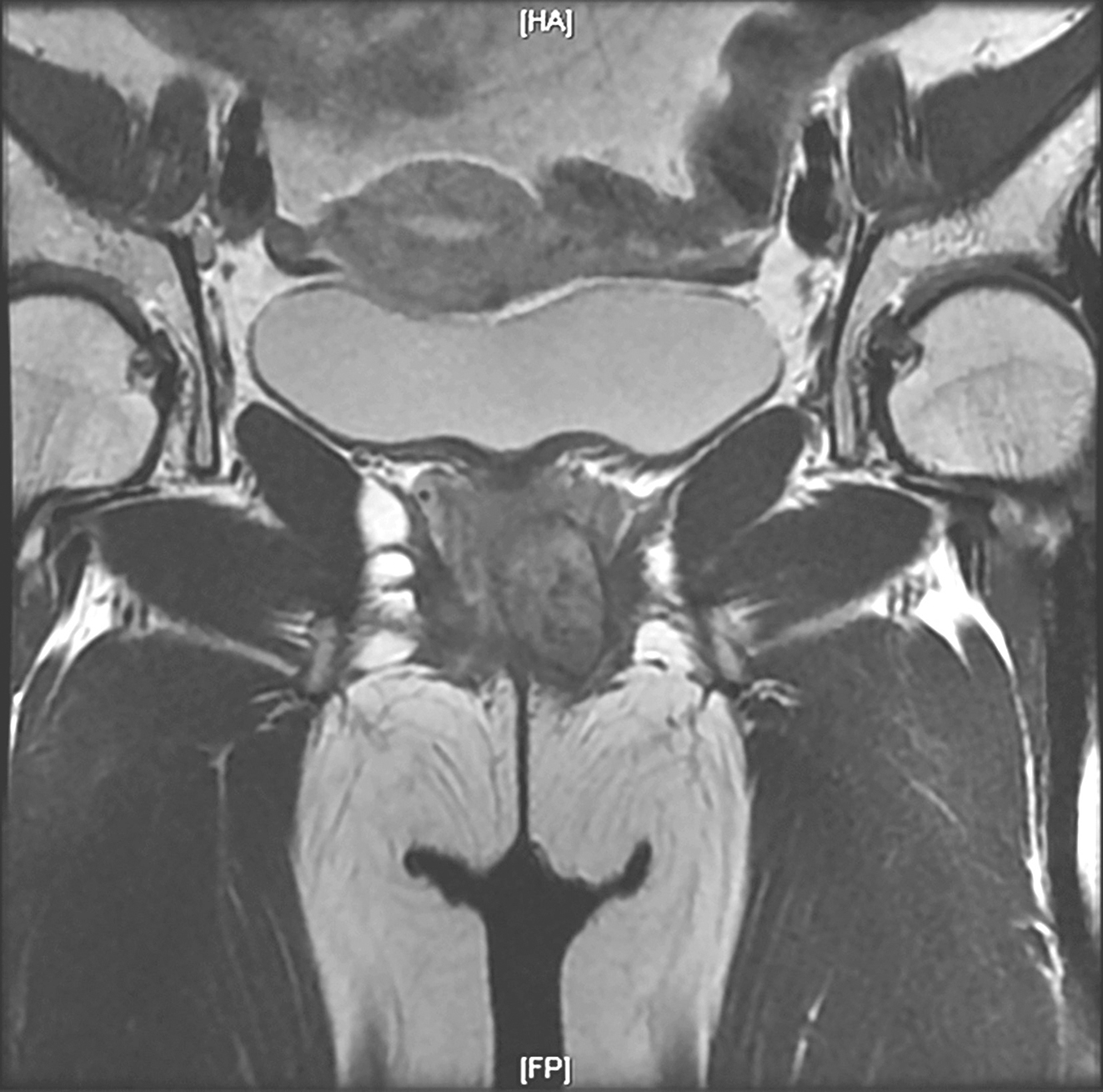
完善经直肠超声:直肠下段及肛管前壁距肛门1cm处可见不均匀低回声,大小约为4.3cm×3.7cm,内部回声不均,内部血流丰富、紊乱,可引出动脉频谱;肿瘤位于腹膜反折以下;耻骨直肠肌、肛门外括约肌完整。经腹超声见盆腔不均匀低回声,大小约5.9cm×4.8cm,与阴道分界不清。经会阴超声见盆腔不均匀低回声,大小约5.2cm×5.5cm,前方距皮肤约0.2cm,边界欠清,形态不规则,内血流信号丰富,可引出动脉频谱。完善PET-CT示:阴道下段与直肠前壁见类圆形肿物,大小约5.0cm×3.5cm×5.9cm,密度稍欠均匀,肿物与阴道、直肠前壁均分界不清,局部突向外阴。术前评估为潜在可切除性直肠GIST,考虑到肿物较大且与周围组织器官关系密切,直接切除有联合脏器切除的可能,且难以保全阴道和肛门功能,遂决定行术前靶向药物治疗。患者从2016年4月15日起,开始口服甲磺酸伊马替尼,400mg/d。此后规律复查,伊马替尼治疗1个月后复查增强CT(图2):直肠下段与阴道间可见类圆形混杂密度影,范围大致约4.2cm×2.5cm×2.6cm,病灶密度不均,其内可见液性密度区,增强扫描实性成分明显强化,病灶局部与直肠前壁及阴道后壁分界不清。对比首诊盆腔MRI,病灶较前缩小(Choi标准:PR状态)。伊马替尼治疗4个月后复查增强CT(图3):直肠下段与阴道间可见类圆形低密度病灶,大小约3.5cm×2.3cm×1.8cm,增强扫描可见轻度强化,病灶局部与直肠前壁及阴道后壁分界不清。对比前次复查:病灶较前略缩小(Choi标准:PR状态)。伊马替尼治疗6个月后复查增强CT(图4):直肠下段与阴道间可见类圆形低密度病灶,大小约3.9cm×2.1cm×1.9cm,增强扫描可见轻度强化,病灶局部与直肠前壁及阴道后壁分界不清。对比前片,病灶较前无明显改变(Choi标准:维持PR状态)。考虑患者术前靶向治疗已进行6月余,且药物治疗效果已达最大化,建议患者接受手术治疗。2016年11月1日门诊以“胃肠间质瘤,靶向治疗后”收入北京大学人民医院胃肠外科。
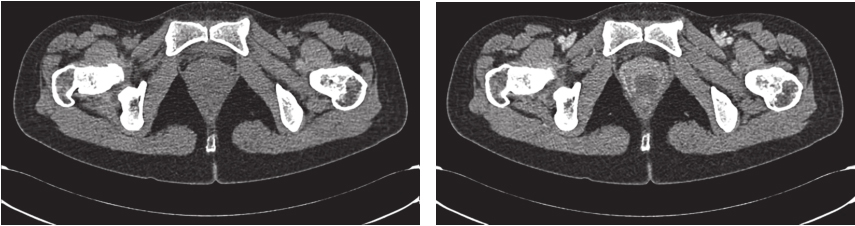
图2 伊马替尼术前治疗1个月后增强CT表现
引自:胃肠间质瘤典型病例诊治与解析.第1版.ISBN:978-7-117-30146-6.主编:陶凯雄 曹 晖
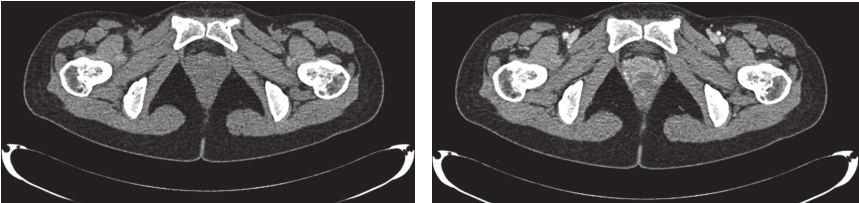
图3 伊马替尼术前治疗4个月后增强CT表现
引自:胃肠间质瘤典型病例诊治与解析.第1版.ISBN:978-7-117-30146-6.主编:陶凯雄 曹 晖
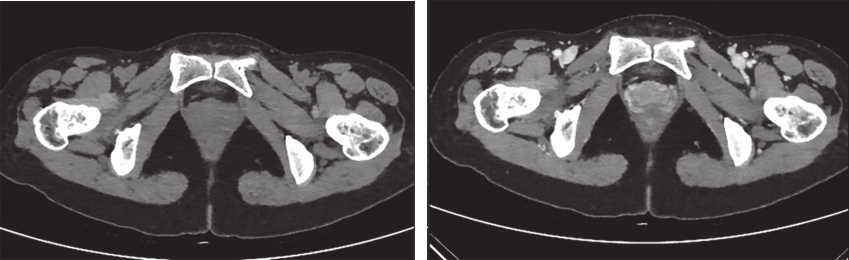
图4 伊马替尼术前治疗6个月后增强CT表现
引自:胃肠间质瘤典型病例诊治与解析.第1版.ISBN:978-7-117-30146-6.主编:陶凯雄 曹 晖
既往史及家族史
既往体健,无特殊病史。月经正常,已婚未育。否认消化系统肿瘤家族史。
体格检查
腹部平坦,未见胃肠型及蠕动波。全腹无压痛、反跳痛、肌紧张,肝脾未触及,腹部未触及包块。移动性浊音阴性。肠鸣音正常。
妇科查体:左侧外阴皮肤见切开活检瘢痕,愈合良好。左侧外阴部皮下可触及肿物,大小约4cm×3cm,质地韧,活动度欠佳,左侧阴道黏膜受肿物膨隆致外翻,阴道口狭窄,进指困难。截石位:阴道入口4~9点位可触及肿物,以9点位为著,有接触性出血,未触及上界。
肛门指诊:膝胸位,肛门形态、皮肤未见明显异常。进指距肛门约2cm处,可于7点位扪及质硬肿物,未及肿物上缘、有触痛。退指指套无染血。
辅助检查
血常规:白细胞4.20×109/L,红细胞4.74×1012/L,血红蛋白138g/L,血小板175×109/L,中性粒细胞百分比 56.6%,淋巴细胞百分比 30.7%。
血生化:未见异常。
盆腔MRI(图5):直肠下段与阴道间GIST,与阴道后壁及直肠前壁分界不清,大小约为3.3cm×2.1cm×1.7cm,与前片比较无显著变化,DWI未见明显高信号,增强扫描未见明显强化。盆腔存在少量积液。
初步诊断
(直肠阴道隔)胃肠间质瘤,靶向治疗后。
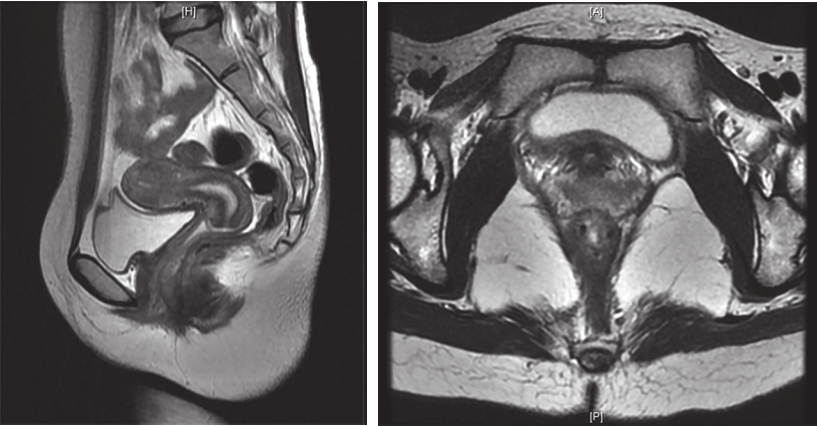
A
B
图5 术前盆腔MRI表现
胃肠间质瘤典型病例诊治与解析
1
978-7-117-30146-6
陶凯雄 曹 晖
【治疗过程】
(一)病例分析
患者为中青年女性,以“胃肠间质瘤,靶向治疗后”就诊。目前诊断明确:胃肠间质瘤,无远处转移。由于肿瘤较大且部位特殊,位于盆底直肠阴道隔,累及阴道及低位直肠,直接切除很难保留肛门及阴道结构,术后势必会影响排粪及性功能,因此先行术前伊马替尼治疗。经6个月400mg/d的伊马替尼治疗,连续两次疗效评估维持PR状态,肿瘤不再缩小,术前靶向治疗效果已达最大化。目前肿瘤可切除,患者一般情况良好,无远处转移,拟行外科手术干预。尽管肿瘤缩小,但与周围组织关系仍密切,界限不清,但术式尽量以局部切除为主,尽量保证R0切除的同时保留肛门和阴道功能。术后再次完善大体标本病理及基因检测,根据结果指导术后辅助靶向治疗。
(二)治疗方案
积极完善术前评估,停服伊马替尼1周后,于2016年11月7日行“肿物切除术+阴道修补术+直肠修补术+回肠暂时性造口术”。截石位术中探查所见:盆腔一质韧实性肿物,边界可,有假包膜,大小约3.5cm×2.5cm,向上侵犯部分阴道后壁,向下与部分直肠前壁粘连。沿肿物边界切除部分受累的阴道后壁。沿肿物后方潜在间隙锐性分离,切除部分直肠前壁肌层组织,检查直肠内黏膜完整无破损,将肿物完整切除。手术过程顺利。
标本情况(图6):肿物位于直肠阴道隔,向前方侵犯阴道后壁,向后方侵犯直肠前壁,大小约3.5cm×2.5cm,质韧,实性,剖面鱼肉样。
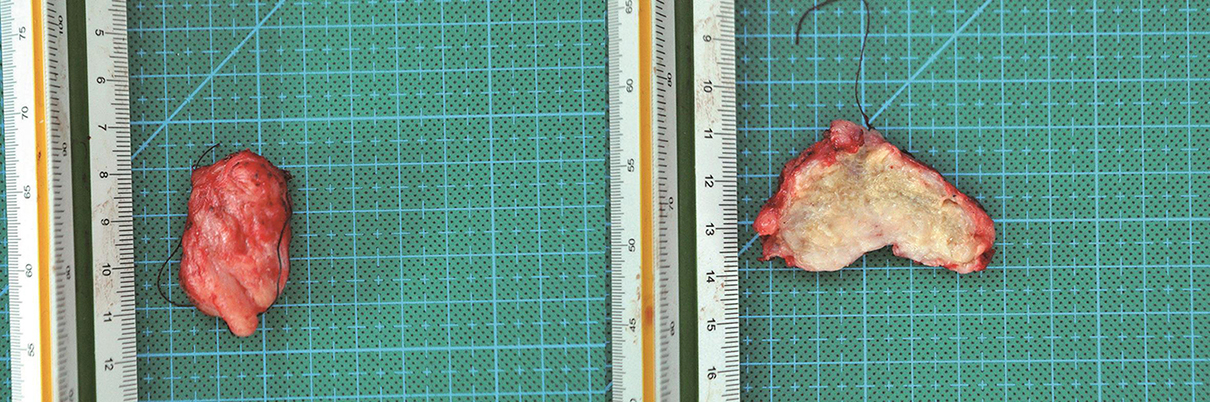
图6 手术切除标本
引自:胃肠间质瘤典型病例诊治与解析.第1版.ISBN:978-7-117-30146-6.主编:陶凯雄 曹 晖
(三)术后病理及基因检测
术后病理:梭形细胞肿瘤,伴广泛变性坏死,局灶细胞丰富,中度异型,核分裂象易见(>10个/50HPF),大小约3.5cm×2.5cm×1.5cm,符合胃肠间质瘤靶向治疗后改变。阴道黏膜:小块黏膜组织,另见少许肿瘤成分。直肠切缘:未见肿瘤成分。
免疫组织化学染色:CD117(+),CD34(+),DOG-1(+),S-100(-),SMA(-),CK(-),Vimentin(+),Desmin(-),Ki-67(Li:约40%)。
基因检测:c-KIT基因11外显子缺失突变(c.1670-1675delGGAAGG.)。
【预后】
患者术后肠道功能恢复良好,术后10天出院,无其他严重并发症。术后3个月行回肠造口还纳手术。首次手术后继续口服伊马替尼400mg/d辅助治疗,截至2019年10月,随访未见复发征象。
【经验与体会】
(一)直肠阴道隔部位EGIST的一般描述
EGIST在间质瘤中占比低于10%,多发于小网膜、大网膜、肠系膜及腹膜后,发生于女性生殖道如外阴、阴道及直肠阴道隔者罕见,原发于直肠阴道隔者更为罕见。国内外报道不多。关于EGIST的组织学起源,学者们认为有几种可能性。最早该类肿瘤被认为是起源于胃肠道的GIST向外生长,在外力等因素作用下,最终脱离消化道形成所谓的EGIST,并非真正的EGIST。后有学者推测EGIST可能起源于胃肠道外的间质细胞,而这些间质细胞在肿瘤发生过程中,异常获得Cajal间质细胞的表型。现已证实胃肠道外器官如子宫、输卵管、膀胱、乳腺、胆囊及胰腺等也存在Cajal间质细胞。因此,较多学者认为EGIST源于胃肠道外Cajal间质细胞的肿瘤性转化,且有文献报道称,正常生理状态下,女性阴道壁也存在细胞形态、表型及功能与胃肠道起搏细胞相同的Cajal细胞。
表1是国内外报道的EGIST发生于阴道或直肠阴道的病例资料。
表1 国内外报道EGIST发生于阴道或直肠阴道的病例情况
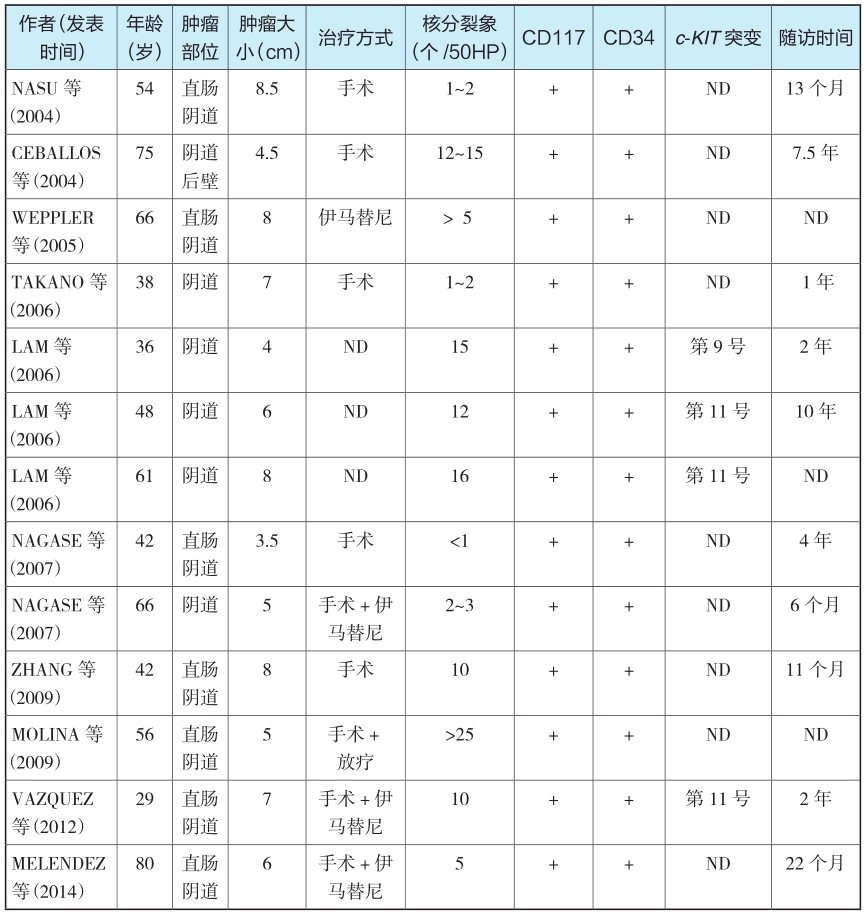
引自:胃肠间质瘤典型病例诊治与解析.第1版.ISBN:978-7-117-30146-6.主编:陶凯雄 曹 晖
(二)EGIST的诊断及鉴别诊断
据报道,阴道EGIST的MRI表现为分叶状卵圆形长T1、稍长T2信号肿块,信号较均匀。增强扫描肿块呈明显较均匀强化,其强化程度与阴道壁基本一致。而本例直肠阴道隔EGIST的MRI表现为结节状肿块,T1WI呈低信号,T2WI呈稍低信号,增强扫描呈渐进性强化。本例T2WI呈稍低信号与上述不符,可能是由于肿瘤发生凝固性坏死导致。
EGIST与GIST病理学特征相似。肉眼观:通常为境界欠清的结节,肿瘤直径2~10cm,切面呈灰白、灰红色,实性,质地细腻,鱼肉状,常缺乏平滑肌瘤的质韧、编织状结构,有时可有明显的坏死、出血及囊性变,瘤组织常侵犯周围组织。镜检:绝大多数瘤细胞为梭形,呈束状交错、漩涡状排列,部分可由上皮样细胞构成,呈弥漫片状或小梁状排列,或出现神经鞘瘤常见的栅栏状排列。
GIST本身可向平滑肌方向分化,易被误诊为平滑肌源性肿瘤。对于女性生殖道,EGIST更需要与平滑肌瘤、平滑肌肉瘤鉴别。在组织学上,平滑肌细胞胞质常呈较强嗜酸性染色,EGIST细胞胞质呈稍淡嗜酸性染色;平滑肌肉瘤细胞具有更明显的多形性和异型性。免疫组织化学染色检测显示,95%GIST表达CD117(c-KIT蛋白)、90%表达DOG-1、60%~70%表达CD34。DOG-1可表达于c-KIT阴性的GIST及PDGFRA突变的GIST。最近有报道称免疫组织化学染色检测PKC-θ的表达对于CD117和DOG-1双阴性GIST的诊断意义重大。此外,30%~40%GIST表达SMA,1%~2%表达desmin,5%表达S-100。相反,平滑肌肿瘤几乎全部表达desmin、SMA及H-Caldesmon,一般不表达CD117、CD34和DOG-1。尽管H-Caldesmon的表达对于向平滑肌方向分化非常特异,但约80%GIST也表达H-Caldesmon。神经鞘瘤一般弥漫表达S-100而不表达CD117和CD34。需要注意的是,CD34、CD117和DOG-1免疫组织化学染色标记阳性的软组织肿瘤并非一定是GIST。一组775例软组织标本的微阵列检测结果显示,少数平滑肌肉瘤、滑膜肉瘤及黑色素瘤也罕见表达CD117、DOG-1及CD34。有文献报道,女性生殖系统的平滑肌肉瘤和子宫内膜间质肉瘤可弥漫表达CD117,但这些肿瘤均不存在c-KIT基因突变。因此,c-KIT分子基因检测在GIST或EGIST病理诊断中具有重要的鉴别意义。c-KIT或PDGFRA基因突变是GIST发病中的关键性机制。约80%的GIST存在c-KIT基因突变,其中80%和15%分别发生于11及9号外显子,<2%发生于13和17号外显子突变。而PDGFRA基因突变GIST仅约30%中无c-KIT基因突变。EGIST中约44%病例存在c-KIT基因突变,多为11号外显子。
(三)EGIST的生物学行为
由于EGIST少见,目前尚无明确、统一的标准评估其生物学行为。GIST的生物学行为因发生部位而不同,通常越靠近胃肠道远端,其恶性潜能越高。而EGIST被认为与发生于胃肠道远端的GIST类似,一般比发生于胃肠道的GIST具有更高的恶性潜能。此外,有研究结果显示,与GIST相反,EGIST的生物学行为与肿瘤大小无相关性,可能与大多数EGIST发现时均已较大有关。Reith等的研究结果显示,EGIST恶性潜能的危险因素包括高细胞密度、核分裂象>2个/50HPF及坏死。少于2个危险因素的患者仅5%预后较差,而2个或多于2个危险因素的患者中95%具有较差的预后。尽管该研究中EGIST多位于肠系膜和腹膜后腔,但基于Reith等的标准,本例患者的组织学特征(较高细胞密度和核分裂象)均属于具有较差的生物学行为的类型。
(四)EGIST的治疗策略
完整的手术切除是EGIST的首选治疗方式。GIST很少发生淋巴结转移,通常无需常规清扫淋巴结,但适当扩大切除范围是恰当的。GIST的放、化疗效果均不明显。酪氨酸激酶抑制剂的辅助治疗有效。EGIST手术治疗的彻底性与疾病预后密切相关,推荐行病灶的整块完整切除。在部分患者中,因周围组织广泛粘连或播散,也应仅行姑息性手术以达到明确诊断或减瘤缓解症状的目的。必要时可在术前进行分子靶向药物治疗,以减小肿瘤体积,降低手术风险,减少术中破裂出血风险较大的肿瘤发生医源性播散的可能性。因EGIST较为少见,现无EGIST肿瘤恶性风险评估的统一标准,故EGIST的恶性风险评估可参照GIST进行。本例患者肿瘤直径约10cm,镜下核分裂象4~6个/50HPF,发生在阴道直肠隔,根据Joensuu对GIST切除后的危险度分级,本例属高危。中高危复发风险患者术后需辅助治疗。目前推荐伊马替尼作为辅助治疗的一线药物。一般主张初始推荐剂量为400mg/d,持续用药1年并随访。
(五)EGIST术后如何随访?
因EGIST术后可出现腹膜和肝脏转移,中、高危患者应该每3个月进行1次CT或MRI检查,持续3年,然后每6个月1次,直至5年;5年后每年随访1次。低危患者应每6个月进行1次CT或MRI检查,持续5年。由于肺部和骨骼转移的发生率相对较低,建议至少每年1次胸部X线检查,在出现相关症状情况下推荐进行ECT骨扫描,必要时进行全身PET-CT检查。
【专家点评】
EGIST是发生于胃肠道以外的原发性GIST,发病率低,临床上较少见,且相关研究欠缺,治疗上缺少统一的规范和标准。EGIST,特别是位于盆底区域(如直肠阴道隔、阴道后壁、膀胱前后区域等)的GIST,由于症状隐匿、不易诊断,因此首次就诊时肿瘤体积就往往较大,直径常大于5cm。盆底区域解剖结构复杂,发生于此区的GIST可能来源于多个器官和组织,难以判断肿瘤起源,这一直是此区GIST须解决的一个临床问题。我们中心曾对这一区域GIST进行研究显示,来源于直肠的最为常见,占68.0%,其后依次是前列腺及膀胱后方区域(12.0%)、阴道后壁(8.0%)、直肠阴道隔(4.0%)、骶前区(4.0%)、膀胱(4.0%)。术前影像学检查有助于检出肿物、判断起源及毗邻关系,其中MRI对肿瘤原发部位的判断准确性最高。对于EGIST,外科手术仍为首选的治疗方式,手术治疗的彻底性与疾病预后密切相关,推荐行病灶的整块、完整切除。然而,对于盆底区域GIST,因为涉及器官保留和功能保护等问题,需要多学科专家协作组的充分讨论,制订以外科治疗为主的多学科综合治疗。
通过本病例的诊治,有以下几点值得借鉴。
(1)EGIST发病率较低,通常起病隐匿,临床症状不同于消化道GIST,需要有一定的临床诊断警惕性。
(2)对于术前诊断肿瘤来源存在困难的EGIST,选择合适的检查手段对于诊断有一定帮助。
(3)对于需要多脏器切除或者功能保护的EGIST,应行术前伊马替尼治疗,穿刺活检有助于明确诊断,并进行基因检测,指导治疗。
(4)一般认为EGIST生物学行为更具侵袭性,通常都需要伊马替尼治疗。
(5)术前治疗期间应定期(每2~3个月)评估治疗效果,优先选用Choi标准,在药物治疗效果最大化时(一般不超过6个月,或者连续两次评估肿瘤不再退缩),及时手术干预,以免贻误手术治疗的最佳时机。
(6)术后应完善病理学检查并再次基因检测,评估有无继发突变等少见情况,指导辅助治疗的实施。
免责声明
内容来源于人卫知识数字服务体系、人卫inside知识库,其观点不反映优医迈或默沙东观点。 此服务由优医迈与胤迈医药科技(上海)有限公司授权共同提供。
如需转载,请前往用户反馈页面提交说明:https://www.uemeds.cn/personal/feedback
[1]DIMOFTE M G, PORUMB V, FERARIUD, et al. EGIST of the greater omentum-case study and review of literature[J].Rom J Morphol Embryol, 2016, 57: 253-258.
[2]ZHANG W, PENG Z, XU L.Extragastrointestinal stromal tumor arising in the rectovaginal septum: reportof an unusual case with literature review[J]. Gynecologic Oncology, 2009, 113:399-401.
[3]中国临床肿瘤学会胃肠间质瘤专家委员会. 中国胃肠间质瘤诊断治疗共识 (2017年版)[J]. 肿瘤综合治疗电子杂志, 2018, 4 (1) : 31-43.
[4]张舒玮, 高志冬, 叶颖江. 盆底区域胃肠间质瘤27例临床病理学特征和预后分析[J]. 中国实用外科杂志, 2018, 38 (5) : 541-545.
[5]APOSTOLOU K G, SCHIZAS D,VAVOURAKI E, et al. Clinicopathological and Molecular Factors, Risk Factors,Treatment Outcomes and Risk of Recurrence in Mesenteric and RetroperitonealExtragastrointestinal Stromal Tumors[J]. Anticancer Res, 2018, 38 (4) : 1903-1909.
[6]YÜKSEL Ö H, AKAN S, YILDIRIM Ç,et al. Extraintestinal gastrointestinal stromal tumor of undetermined origin:Is the mass resection a wrong approach?A case reportand review of the literature[J]. Arch Ital Urol Androl, 2015, 87 (2) : 177-178.
[7]REITH J D, GOLDBLUM J R, LYLESR H, et al. Extra gastrointestinal (soft tissue) stromal tumors: an analysis of48 cases with emphasis on histologic predictors of outcome[J]. Mod Pathol.2000, 13 (5) :577-585.
[8]JOENSUU H, VEHTARI A, RIIHIMÄKIJ, et al. Risk of recurrence of gastrointestinal stromal tumour after surgery:an analysis of pooled population-based cohorts[J]. Lancet Oncol, 2012, 13 (3) :265-274.
人卫知识数字服务体系





 Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
