在伊马替尼问世之前,复发转移的巨大胃肠间质瘤(gastrointestinal stromal tumor,GIST)患者的生存质量和生存率都较低,外科手术切除风险较大,较难达到R0切除,患者术后预后不佳。伊马替尼的出现在一定程度上改变了这一现状,目前越来越多的学者认为,伊马替尼术前治疗联合外科手术对该类患者有一定疗效。术前治疗可以缩小肿瘤大小,提高手术R0切除率,减少手术并发症,从而改善患者预后。本例为1例典型的复发转移巨大GIST患者案例,供各位读者学习。
【病例摘要】
患者,男性,64岁。患者自述因“黑便30天”,于2011年3月赴当地医院就诊。当地医院行电子内镜检查示:胃底有一约3.0cm×3.0cm半球状隆起。当地医院遂行胃底肿块切除术,术中标本病理结果显示:胃底一4.0cm×4.0cm大小GIST,改良NIH危险度分级:中危。术后未予伊马替尼靶向治疗,未规律复查随诊。
2016年11月患者诉腹痛黑便,于当地医院门诊复查超声提示:左上腹实质性占位性肿块(胃来源可能性大),考虑胃肠间质瘤复发可能,建议到上级医院就诊。
患者为求进一步诊治,于华中科技大学同济医学院附属协和医院胃肠间质瘤专病门诊就诊。门诊CT示:胃脾胰左肾间见一最大截面积约17cm×12cm不规则团块软组织密度影,密度不均,边界欠清,明显不均匀强化,建议患者行活检穿刺及c-KIT/PDGFRA基因检测,结果示c-KIT基因外显子11突变。结合患者病史,考虑为GIST复发,进行全面评估后认为目前手术切除风险大,难以达到R0切除。建议患者采用伊马替尼术前治疗(400mg/d)联合外科手术治疗方案,并嘱患者定期复查CT。
患者服药4个月后于当地医院复查CT示:与前片比较,胃脾胰左肾间不规则团块状软组织密度影范围较前缩小,密度不均,轻中度不均匀强化,内见多发杂乱走行之血管影,病灶局部与胃脾分界不清,胰尾及左肾呈外压性改变,脾周少许积液,评估为部分缓解,建议继续予伊马替尼术前治疗。
患者服药12个月后复查CT示:与前片比较,软组织密度影范围未见明显缩小,最大截面积约12.9cm×10.3cm,评估为稳定状态,伊马替尼术前治疗疗效已到最大反应效应;患者存在继发耐药风险。建议患者可终止术前治疗,择期行手术切除病灶,但患者拒绝(图1)。
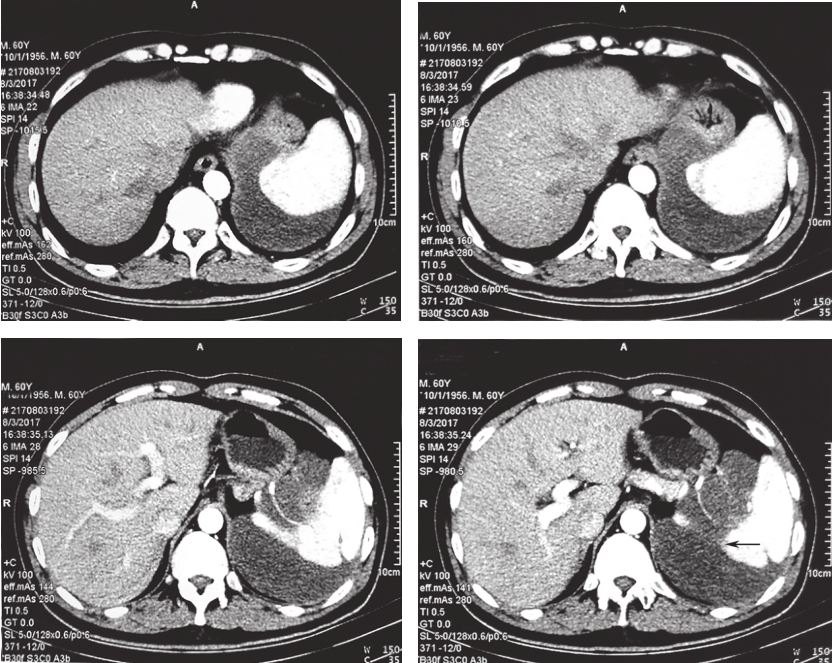
图1 2017年11月30日增强CT
患者服药18个月后复查CT示:与前片比较,软组织密度影范围无显著变化。患者考虑个人时间安排原因,决定延后手术时间(图2)。
患者于2018年9月22日以“胃肠间质瘤切除术后复发”收治于华中科技大学同济医学院附属协和医院胃肠外科,行外科手术治疗。
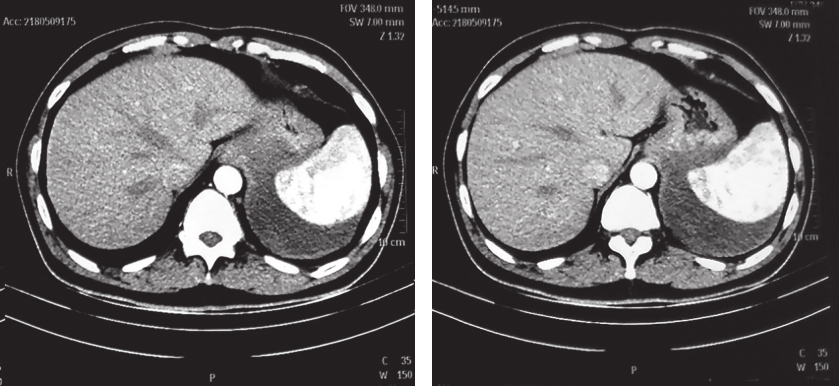
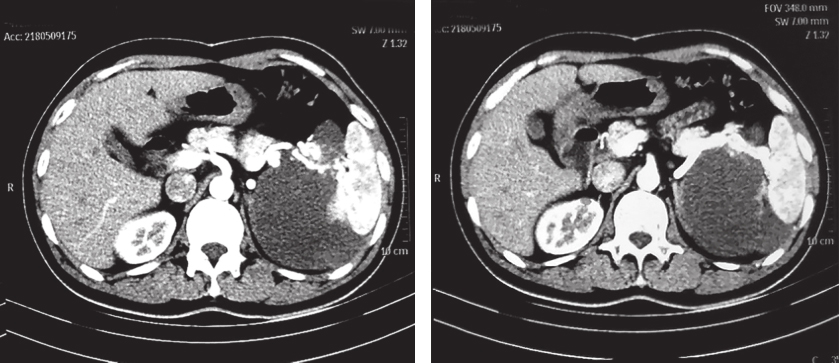
图2 2018年5月9日增强CT
既往史及家族史:既往身体欠佳,无其他系统疾病;手术史:2011年3月3日胃底胃肠间质瘤切除术;输血史:有。无药物过敏史。父母已故,家族中无类似病史。
体格检查:生命体征平稳,皮肤黏膜无黄染、无苍白。腹部平坦,未见胃肠型及蠕动波。腹部无明显压痛及反跳痛;腹部正中可见一长约8cm的手术瘢痕。肠鸣音正常。
辅助检查:
血常规:白细胞3.20×109/L↓,红细胞3.56×1012/L↓,血红蛋白115g/L↓,血小板109×109/L↓,中性粒细胞百分比65.00%,淋巴细胞百分比24.3%
血生化:总胆红素4.8μmol/L↓,直接胆红素2.6μmol/L,丙氨酸转氨酶24U/L,天门冬氨酸转氨酶49U/L,总蛋白 56.6g/L↓,白蛋白31.8g/L↓,肌酐72.1μmol/L,尿素氮5.41mmol/L,钠136.0mmol/L,钾3.96mmol/L,氯 101.5mmol/L
肿瘤标志物:未见明显异常
初步诊断:
1.(胃)胃肠间质瘤术后复发
2.复发性胃肠间质瘤术前治疗后
【治疗过程】
(一)病例分析
患者为中年男性,于2016年以“胃GIST切除术后5年”就诊于华中科技大学同济医学院附属协和医院。患者自述于2011年GIST术后未行伊马替尼辅助治疗。2016年门诊CT检查提示腹腔一巨大肿物占位,考虑诊断为“腹腔占位:胃底GIST复发?”。基因检测结果示患者为c-KIT基因外显子11突变,建议患者采用伊马替尼术前治疗联合手术的诊疗方案。2017年11月患者复查CT结果示:病灶从2016年12月肿瘤最大直径17cm缩小至10cm,且与前片比较,肿瘤大小已无明显变化。经科室讨论后意见:患者术前治疗11个月,已达最大效应,继续治疗有继发耐药的风险。患者因个人原因拒绝手术,选择继续术前治疗。术前治疗总计22个月,但比较幸运的是患者没有出现耐药的情况。
(二)治疗方案
患者于2018年9月27日行“剖腹探查术+腹膜后肿瘤切除术+脾切除术+胰腺部分切除术+胃肿瘤部分切除术”。术中可见腹腔内致密粘连,左上腹可见一V字形肿物,包绕脾脏及胰尾,贲门口可见一外生性肿物(图3),大小约4cm×3cm。完整切除胃壁及肿瘤,清点纱布及器械后逐层关腹。手术时间420min,手术过程顺利,出血量约400ml。
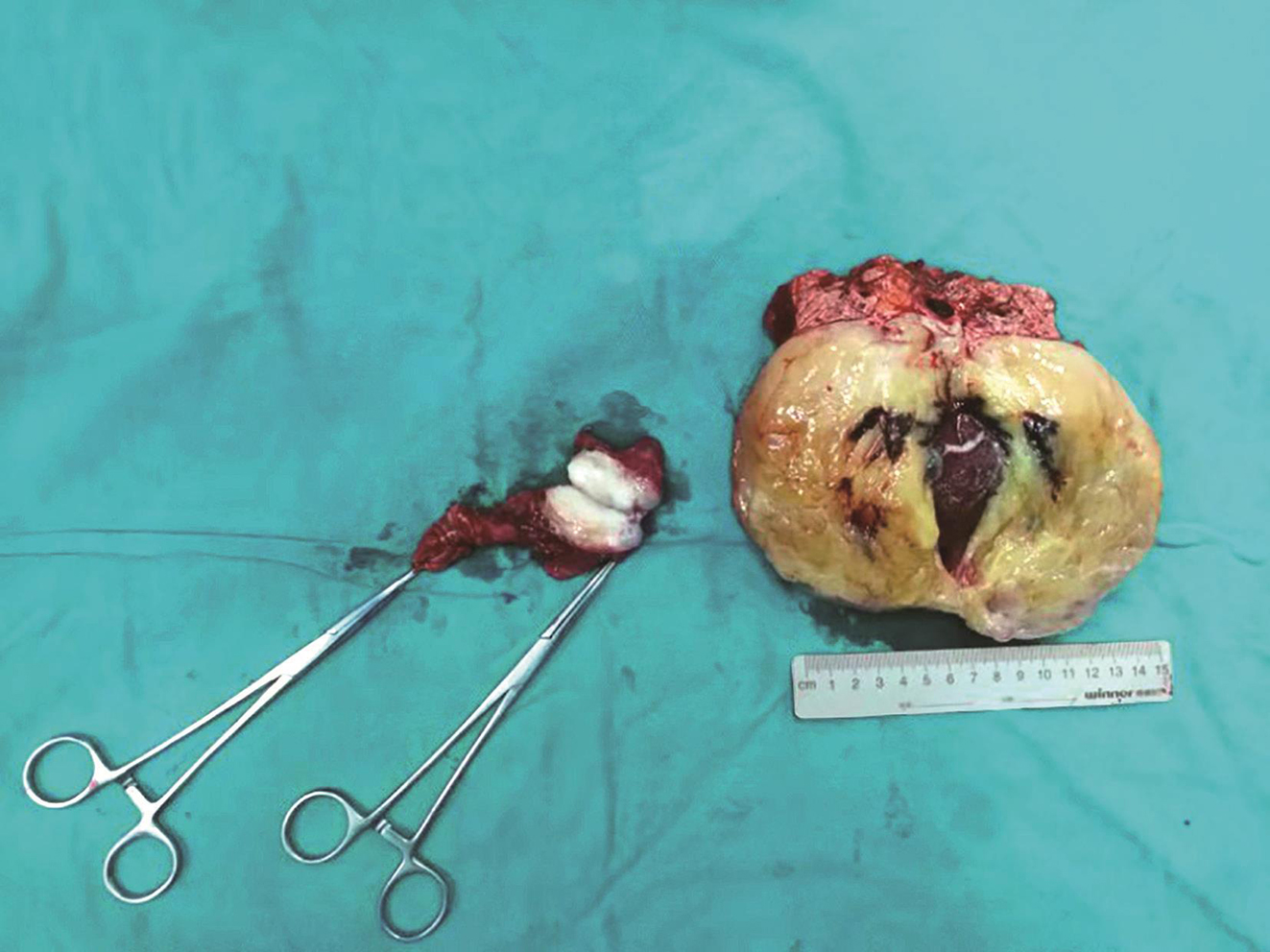
图3 术后大体标本
(三)术后病理及基因检测
病理诊断:结合病史,符合转移性胃肠间质瘤伊马替尼治疗后改变。①(左上腹)胃肠间质瘤(15cm×9cm×8cm),核分裂象<5个/50HPF;②(胃底)胃肠间质瘤(5cm×5cm×2cm),核分裂象<5个/50HPF。上述两个肿瘤,靶向治疗后均为中度效应。
免疫组织化学染色:CD117(部分+),DOG-1(部分+),CD34(+),S-100(灶状+),SMA(-),SDHB(+),Ki-67(Li<1%)。
2016年11月基因检测:患者c-KIT基因外显子11发生突变,突变类型为c.1669_1674delTGGAAG(p.W557_K558del);PDGFRΑ基因外显子12、18为野生型。
2018年12月基因检测:患者c-KIT基因外显子11发生突变,突变类型为c.1669_1674delTGGAAG(p.W557_K558del);PDGFRΑ基因外显子12、18为野生型。
【预后】
患者于术后第12天恢复出院。口服阿司匹林肠溶片,100mg/d,每周复查血小板变化。患者术后2周开始行伊马替尼靶向治疗,2018年12月11日复查B超CT结果提示无肿瘤复发转移灶,凝血功能检查示无异常。
【经验与体会】
(一)转移复发的巨大GIST的治疗选择。
外科手术完整切除是巨大GIST首选的治疗方案,但本例患者的肿瘤最大直径达17cm且复发转移灶有3处。经科室讨论分析:因存在瘤体巨大,术中出血风险较高;CT显示瘤体位置不佳,与胃、脾、胰、左肾边界不清,手术范围较大;不易达到R0切除等不利因素,决定采用伊马替尼术前治疗联合外科手术的转化治疗方案。
转化治疗是指部分患者经靶向药物治疗后可获得外科手术切除的机会,属于术前治疗的新范畴。近年来,随着晚期实体肿瘤转化治疗观念的兴起,对晚期GIST患者使用伊马替尼进行转化治疗的临床应用也逐步得到认可。欧洲一项大规模多中心的回顾性分析共纳入239例转移性GIST,术前84%的患者已在服用伊马替尼。研究根据手术结果将患者分为R0-R1组(共177例)和R2组(62例),术前两个组服用伊马替尼的中位时间分别为14和13个月。R0-R1组中位OS为8.7年,R2组则为5.3年。该项研究提示术前治疗时间可为6~12个月,且在未发生疾病进展前行转移灶或残留病灶切除术可使患者生存获益;而疾病进展时再手术的患者发生复发转移时间更早,几乎不能实现生存获益。来自亚洲的一项回顾性分析也显示了伊马替尼术前治疗联合外科手术对于复发转移性GIST在生存获益方面的优势。研究共纳入134例复发转移性GIST,均为伊马替尼治疗有效且疾病稳定6个月以上后入组,其中42例经手术切除转移灶(手术组),92例只用伊马替尼维持治疗,中位随访时间为58.9个月。该项研究中,相比于非手术组,手术组PFS和OS均有显著性优势。
(二)GIST术前治疗时间及手术时机选择
目前关于GIST术前治疗的持续时间及手术时机仍存在争议,主要因为GIST基因突变类型多样,对伊马替尼敏感性差异较大,且在治疗过程中可能发生继发的突变。因此,各指南均指出术前治疗的持续时间应以达到药物治疗最大反应为标准。盲目延长伊马替尼术前治疗时间极有可能导致耐药,进而错失最佳的手术时机。安德森癌症中心的一项回顾性研究入组了93例术前治疗的GIST患者,其中41例为局部进展期,中位术前治疗时间为315天。该项研究显示术前治疗时间>365天与复发率增高相关。因此,对于初始可切除的局部进展期GIST,术前治疗时间应以12个月内为宜。同时,对于巨大GIST的术前治疗时间和手术时机的另一个判断标准是术前治疗达到药物最大反应时点,判断方法多采用CT/MRI扫描,如果连续增强CT或MRI扫描提示肿瘤无缓解,即认为达到最大反应时间,通常为6~12个月,此时如有手术机会应尽早进行手术切除。各指南中关于术前治疗时长的推荐也存在差异。NCCN指南中推荐“≥6个月或最大反应时”;ESMO指南中推荐“6~12个月或最大反应时”。中国专家共识的推荐则由2013年版的“6个月适宜”转变为2017年版的“6~12个月”。
患者2017年11月达伊马替尼术前治疗最大效应,专家组认为继续术前治疗存在继发耐药的风险,建议及时进行手术切除治疗。但是由于患者个人原因,于2018年9月才行外科手术切除。该患者的术前治疗时间较长,存在继发耐药事件发生的可能性。为减少该不良事件的发生,目前最佳方案是治疗期间定期行CT/MRI影像学检查以评估肿瘤大小是否获得缓解。若无缓解则可认为达到最大效应,应尽快行外科手术切除病灶。
【专家点评】
巨大GIST的临床表现主要取决于肿瘤大小、部位及生长方式。由于巨大GIST血供丰富,较容易侵犯黏膜层从而引起胃肠道出血甚至大出血,以胃肠道出血来就诊的患者并不在少数。对于此类患者,一方面需要密切观察生命体征,必要时输血;另一方面,外科手术完整切除是巨大GIST的首选治疗方式。就手术方式而言,巨大GIST体积较大,一般采用传统开腹手术方式,也可先行腹腔镜辅助探查,探明瘤体具体位置、与周围脏器粘连和血供情况后行简单的粘连分离后再行开腹手术。术中应避免肿瘤破裂,保持肿瘤的完整性。而巨大GIST胃肠道出血是否等同于肿瘤破裂这一争论,我中心研究数据表明,GIST胃肠道腔内出血并不等同肿瘤的腹腔破裂;同时,以胃肠道出血为首发表现的小肠GIST确诊时肿瘤体积相对较小,较其他临床表现的小肠GIST预后更佳。当然,胃肠道出血对预后的影响还需要更多中心、更多样本量的临床数据去验证和探究。
免责声明
内容来源于人卫知识数字服务体系、人卫inside知识库,其观点不反映优医迈或默沙东观点。此服务由优医迈与胤迈医药科技(上海)有限公司授权共同提供。
如需转载,请前往用户反馈页面提交说明:https://www.uemeds.cn/personal/feedback
[1] LI K, CHENG H, LI Z, et al. Genetic progression in gastrointestinal stromal tumors: mechanisms and molecular interventions [J] . Oncotarget, 2017, 8 (36): 60589-60604.
[2] LI J, YE Y, WANG J, et al. Chinese consensus guidelines for diagnosis and management of gastrointestinal stromal tumor [J] . Chinese journal of cancer research, 2017, 29 (4): 281-293.
[3] 罗云, 王崇树, 魏寿江, 等. 中国普通外科杂志 [J] . 巨大胃肠间质瘤39例临床分析. 2015, 24 (10):1383-1388.
[4] ZHANG P, ZENG X, GAO J, et al. [Clinical characteristics and prognosis analysis of 119 cases with giant gastrointestinal stromal tumor] [J] . Chinese journal of gastrointestinal surgery, 2016, 19 (11): 1290-1295.
[5] WANG S, SHEN L. Efficacy of Endoscopic Submucosal Excavation for gastrointestinal stromal tumors in the cardia [J] . Surgical laparoscopy, endoscopy&percutaneous techniques, 2016, 26 (6): 493-496.
[6] FENG Y, YU L, YANG S, et al. Endolumenal endoscopic full-thickness resection of muscularis propria-originating gastric submucosal tumors [J] . Journal of laparoendoscopic & advanced surgical techniques, 2014, 24 (3): 171-176.
[7] KERMANSARAVI M, ROKHGIREH S, DARABI S, et al. Laparoscopic total gastrectomy for a giant gastrointestinal stromal tumor (GIST) with acute massive gastrointestinal bleeding: a case report [J] . Wideochir Inne Tech Maloinwazyjne. 2017; 12 (3): 306-310.
[8] MILONE M, ELMORE U, MUSELLA M, et al. Safety and efficacy of laparoscopic wedge gastrectomy for large gastrointestinal stromal tumors [J] . European journal of surgical oncology: the journal of the European Society of Surgical Oncology and the British Association of Surgical Oncology, 2017, 43 (4): 796-800.
[9] SEVERINO B U, FUKS D, LAINAS P, et al. Large gastrointestinal stromal tumours of the stomach: Is laparoscopy reasonable? [J] Journal of minimal access surgery, 2016, 12 (2): 148-153.
[10] LEE J H, KIM Y, CHOI J W, et al. Correlation of imatinib resistance with the mutational status of KIT and PDGFRΑ genes in gastrointestinal stromal tumors: a meta-analysis [J] . JGLD, 2013, 22 (4): 413-418.
[11] 中国医师协会外科医师分会胃肠间质瘤诊疗专业委员会, 中华医学会外科学分会胃肠外科学组. 胃肠间质瘤规范化外科治疗中国专家共识 (2018版) [J] . 中国实用外科杂志, 2018, 38 (9): 1005-2208.
[12] 史一楠, 梁小波. 胃肠间质瘤的伊马替尼新辅助治疗及手术时机的选择 [J] . 中华胃肠外科杂志,2015, (4): 1674-0274.
[13] 邱海波, 孙晓卫, 周志伟. 胃肠间质瘤辅助治疗研究新进展 [J] . 中华胃肠外科杂志, 2017, 20(9): 1671-0274.
[14] BEDNARSKI B K, ARAUJO D M, YI M, et al. Analysis of prognostic factors impacting oncologic outcomes after neoadjuvant tyrosine kinase inhibitor therapy for gastrointestinal stromal tumors [J] . Ann Surg Oncol, 2014, 21 (8): 2499-2505.
[15] BAUER S, RUTKOWSKI P, HOHENBERGER P, et al. Long-term follow up of patients with GIST undergoing metastasectomy in the era of imatinib—analysis of prognostic factors (EORTC-STBSG collaborative study) [J] . Eur J Surg Oncol, 2014, 40 (4): 412-419.
[16] CSCO胃肠间质瘤专家委员会. 中国胃肠间质瘤诊断治疗共识 (2013年版) [J] . 临床肿瘤学杂志,2013, 8 (11): 1025-1032.
[17] VON MEHREN M, RANDALL R L, BENJAMIN R S, et al. Soft Tissue Sarcoma, Version 2. 2018, NCCN Clinical Practice Guidelines in Oncology [J] . J Natl Compr Canc Netw, 2018, 16 (5): 536-563.
[18] CASALI P G, ABECASSIS N, ARO H T, et al. Gastrointestinal stromal tumours: ESMO-EURACAN Clinical Practice Guidelines for diagnosis, treatment and follow-up [J] . Ann Oncol, 2018, 29 (Suppl 4):68-78.
知识来源
人卫知识数字服务体系





 Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.