直肠胃肠间质瘤(gastrointestinal stromal tumor,GIST)发病率较低,多发生在中低位直肠。由于直肠解剖位置特殊、盆腔内空间狭小、与诸多盆底重要脏器或结构毗邻、手术治疗常涉及直肠肛门功能保护问题,直肠GIST的诊疗缺乏统一的共识与标准。临床上,对于直径较小的直肠GIST,局部切除既能实现R0切除,又能避免盆底重要脏器结构和功能的破坏。然而,对于较大的直肠GIST,为了实现肿瘤的完整切除,常常需要借助于直肠癌的术式,并常可因局部组织器官的直接破坏或对盆腔自主神经的损伤而造成尿、便以及性功能障碍。在靶向治疗时代,术前靶向治疗可能缩小肿物、实现局部降期、增加完整切除率、提高保肛概率,从而改善患者无病生存率和术后生活质量。
【病例摘要】
患者,男性,38岁,2017年3月因“体检发现盆腔肿物2周”就诊。完善盆腔MRI(图1)、经直肠超声等检查,考虑盆腔内间叶源性肿瘤伴出血。PET-CT示:盆腔膀胱、直肠间见一软组织肿块,大小约9.4cm×12.2cm×11.5cm,代谢活跃,倾向恶性病变。经直肠肿物穿刺活检病理示:梭形细胞肿瘤,免疫组织化学染色提示胃肠间质瘤:CD117(+),CD34(+),DOG-1(+),Desmin(-),S-100(-),SMA(-),Ki-67(Li:5%)。 穿 刺组织基因检测:c-KIT基因9外显子点突变(c.1509-1510insGCCTAT.)。术前评估为可切除性直肠GIST,但考虑到肿物较大且与周围组织器官关系密切,直接切除有联合脏器切除可能,且难以保留肛门功能,遂决定行术前靶向药物治疗。
从2017年4月10日起,开始口服甲磺酸伊马替尼400mg/d。服药后每月复查盆腔MRI,示肿瘤无明显变化。考虑患者术前伊马替尼靶向治疗2月余,肿物仍无明显缩小,患者系c-KIT外显子9突变,该型突变对伊马替尼反应欠佳,建议患者增加剂量至600mg/d。患者遵医嘱于2017年6月28日开始加量。伊马替尼加量后2个月复查盆腔MRI,示肿物大小较前仍无显著变化(Choi标准:SD状态)。加做腹盆腔增强CT:盆腔内直肠膀胱窝见一巨大类椭圆形实性肿物,考虑GIST或其他间叶源性肿瘤,肿物边缘光滑,可见包膜,与精囊、前列腺及直肠分界不清,肿物大小约11.7cm×8.9cm,密度欠均匀,内见条片形稍高密度影及散在钙化灶(图2)。
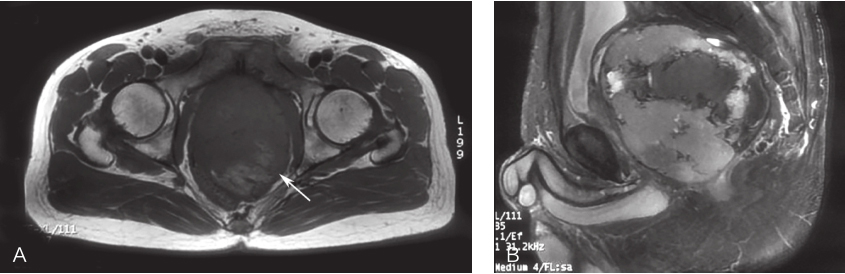
图1 首诊盆腔MRI表现
A.横断面;B.矢状面
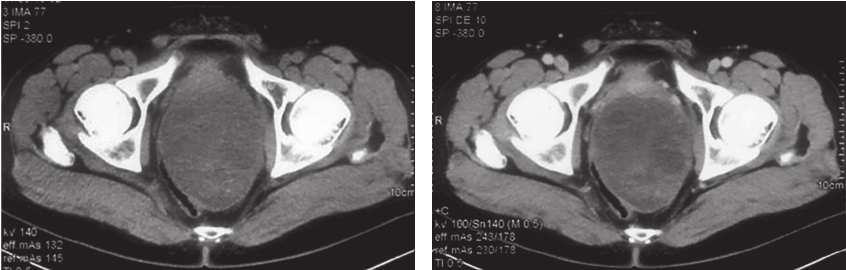
图2 经伊马替尼术前治疗5个月后CT表现
此后每2个月复查盆腔增强CT至2017年12月6日,均提示肿物大小及密度较前无显著变化(Choi标准:SD状态)。经评估认为患者对伊马替尼药物治疗效果不佳,无法达到缩小肿瘤的目的,建议患者考虑手术切除或者改用苹果酸舒尼替尼治疗。患者拒绝手术,于2017年12月14日开始服用苹果酸舒尼替尼37.5mg/d。舒尼替尼治疗后1个月腹盆腔增强CT示,肿物大小约10.7cm×9.6cm,病灶主体平扫CT值约12~40HU,大小及密度较前无明显变化(Choi标准:SD状态)。苹果酸舒尼替尼治疗后4个月复查腹盆腔增强CT示,肿物大小约9.4cm×7.0cm,较前缩小,CT值无显著变化(Choi标准:PR状态,图3A),继续服用苹果酸舒尼替尼治疗。舒尼替尼治疗后7个月复查腹盆腔增强CT示,肿物大小(约9.4cm×7.2cm)及密度较上次检查结果无显著变化(图3B)。评估认为苹果酸舒尼替尼术前治疗目前已连续两次检查结果显示肿瘤不再缩小,治疗效果已最大化,继续用药有继发耐药及肿瘤再次增大可能。建议患者接受手术治疗。患者拒绝手术治疗,要求继续服用苹果酸舒尼替尼。2个月后(2018年9月27日)再次复查胸腹盆腔增强CT,示肿瘤大小(9.1cm×7.3cm)及密度较前仍无明显变化,患者同意接受手术治疗,遂停止服用舒尼替尼。于2018年10月6日,门诊以“(直肠)胃肠间质瘤,靶向治疗后”收入院。
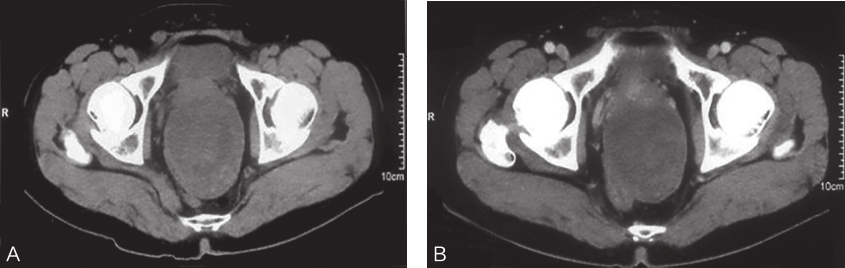
图3 舒尼替尼术前治疗后增强CT表现
A.治疗4个月后CT表现;B.治疗7个月后CT表现
既往史及家族史
强直性脊柱炎病史16年,确诊后服用柳氮磺吡啶2年后停药,疾病控制可;HBV携带者病史30年,未行抗病毒治疗。否认药物过敏史。否认消化道肿瘤家族史。
体格检查
腹部平坦,未见胃肠型及蠕动波。全腹无压痛、反跳痛、肌紧张,肝脾未触及,腹部未触及包块。移动性浊音阴性。肠鸣音正常。
直肠指诊:膝胸位进指即可触及盆腔肿物,位于直肠前方偏左,呈外生性生长,质韧,难以评估大小、边界、起源以及起源处距肛缘距离。直肠黏膜光滑,肠腔通畅。退指指套无染血。
辅助检查
血常规:白细胞 3.00 ×109/L↓,红细胞 3.64 ×1012/L↓,血红蛋白 127 g/L↓,血小板156 ×109/L,中性粒细胞百分比 36.5%↓,淋巴细胞百分比 52.4%↑。
血生化:未见异常。
2017年3月盆腔MRI示:盆底直肠膀胱间隙见T2较高T1较低信号软组织影,直径约10cm,病变内部信号不均匀,见多发不规则大片状T1较高T2等信号区,并见气-液平面,考虑间叶组织源性肿瘤伴瘤内出血;DWI序列环周呈高信号,中心大片呈低信号区;病灶推挤膀胱、前列腺及精囊向前上方移位,推挤直肠向后移位,大部分边界清。
2018年10月胸腹盆腔增强CT(图4):①盆腔见一软组织肿块,大小约9.1cm×7.3cm,边界尚清,挤压相邻直肠、前列腺及双侧精囊,局部分界稍欠清,平扫内部密度不均,可见点状及片状稍高密度灶,增强扫描强化不明显;②肝脏大小形态未见异常,表面光滑,肝叶比例协调,肝实质内见小囊状低密度灶,大小约0.3cm,增强扫描未见强化;③腹腔未见液性密度影,腹腔及腹膜后未见明显淋巴结肿大。
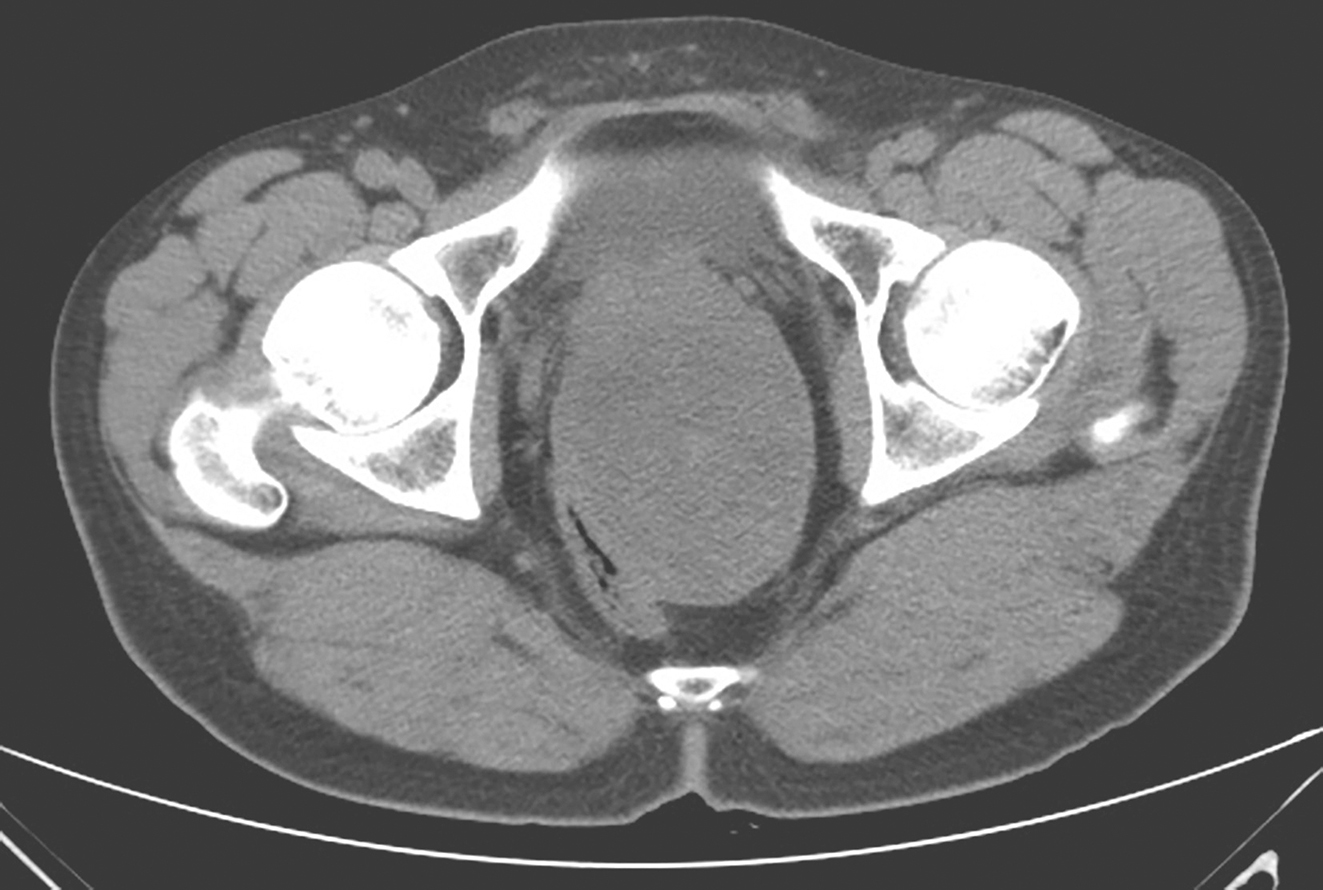
图4 术前腹盆腔增强CT表现
初步诊断
1.直肠胃肠间质瘤,靶向治疗后
2.轻度贫血
3.强直性脊柱炎
【治疗过程】
(一)病例分析
患者为中年男性,以“直肠胃肠间质瘤,靶向治疗后”就诊。目前诊断明确:(直肠)胃肠间质瘤,无远处转移,c-KIT基因外显子9突变,经2个月400mg/d+6个月600mg/d伊马替尼治疗,疗效评估SD状态,后更换为37.5mg/d舒尼替尼治疗4个月,出现PR状态;再治疗5个月肿瘤未见缩小,术前靶向治疗效果已达最大化,继续术前治疗存在耐药风险,应行外科手术干预,争取R0切除,由于肿瘤与周围组织关系仍密切,界限不清,保肛手术难度较大。术后再次完善大体标本病理及基因检测,根据结果指导术后辅助靶向治疗。
(二)治疗方案
积极完善术前评估,停用舒尼替尼约2周后,于2018年10月11日行剖腹探查术,术中所见:腹盆腔无积液,肝脏及腹腔内未见转移结节。盆腔腹膜返折以下可及肿物,占据整个盆腔,活动度差。因肿瘤巨大占据整个盆腔,间隙狭窄且粘连严重,经腹直肠分离过程困难,强行保肛难以获得安全切缘。遂决定行肛提肌外腹会阴联合直肠根治性切除术(ELAPE) +乙状结肠永久性造口术。手术过程尚顺利。
标本情况(图5):肿物位于直肠下段侧壁,大小约9cm×8cm×7cm,累及前列腺后壁,假包膜完整。
(三)术后病理及基因检测
术后病理:①(直肠)胃肠间质瘤,大小约9cm×8cm×6.5cm,伴广泛变性坏死及出血,结合临床病史符合治疗后表现,残留肿瘤组织中偶见核分裂象(1个/50HPF)。前列腺组织未见肿瘤侵犯。②前列腺、尾骨、肛门组织未见肿瘤侵犯,上下切缘、环周切缘净。
免疫组织化学染色:CD117(+),CD34(+),DOG-1(+),Desmin(-),SMA(-),PDGFR(+),SDHB(+),Ki-67(Li:20%)。
基因检测:c-KIT基因9外显子点突变(c.1509-1510insGCCTAT.),11外显子、13外显子、14外显子、17外显子和18外显子未见突变;PDGFRA基因12外显子和18外显子未见突变;KRAS及BRAF基因未见突变。
【预后】
患者术后肠道功能恢复良好。患者术后早期有晨勃反应,出院日常生活能力评估量表中控制小便能力可。因术后时间较短,目前暂无随访数据。
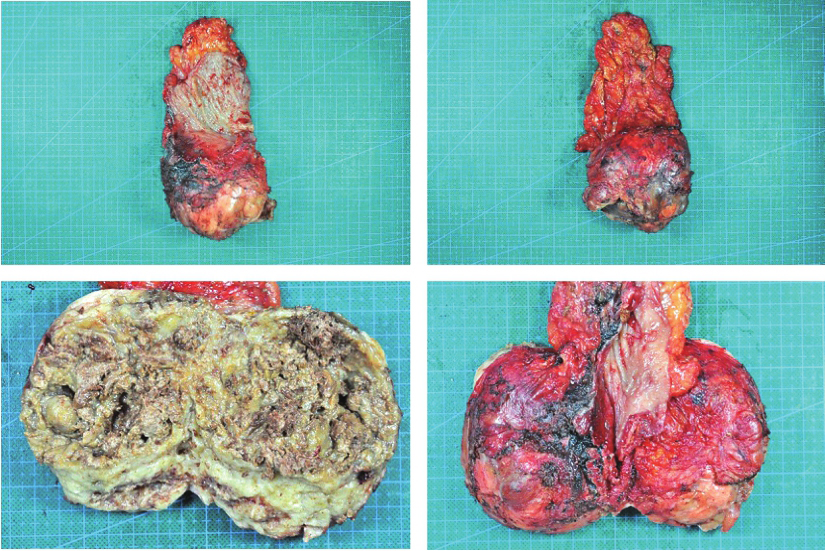
图5 手术切除标本
【经验与体会】
(一)如何早期发现、及时诊断、精准评估直肠GIST?
GIST本身是一种交界性肿瘤,其预后远远优于癌。针对直肠GIST,早期发现病变无疑意义非凡:不仅可以减少肿瘤发生远处转移的机会,并且早期发现较小病变可以控制手术的范围,避免扩大切除手术以及由此导致的永久性造口和盆底器官功能障碍等问题。该病例因直肠GIST行ELAPE术式无法保肛令人遗憾,如能早期发现及早治疗,或可避免永久性造口。然而,对于直肠GIST这种非黏膜、非浆膜的肌源性病变,临床表现隐匿,主要与肿瘤的大小、所侵犯组织器官相关。直肠小GIST通常无临床症状;超过2cm者。部分可按其生长方式有相关临床表现,如内生型者出现大便性状和排粪习惯改变、外生型者会压迫和侵犯周围组织导致盆底疼痛等症状。然而,本例患者肿瘤已超过10cm,仍未引起明显临床症状,可见直肠GIST的隐匿性甚至超过直肠癌。因此,临床医生应提高警惕,不要轻易放过任何可疑症状。绝大多数直肠GIST位于中低位,约1/3可通过直肠指诊发现,因此,我们特别推崇这一简单有效的检查手段。发现直肠肿物后,应积极完善内镜、内镜超声(EUS)、经直肠超声、经阴道超声、CT、MRI等检查,综合评估判断是否存在多发病变或者远处转移、肿瘤浸润肠壁的深度、肛门括约肌是否累及、区域淋巴结转移、TME的环周切缘(CRM)情况、毗邻器官是否受累等,其中盆腔MRI和超声内镜诊断直肠GIST的敏感度和特异度均较高,联合应用可以提高诊断的准确性。
(二)直肠GIST术前活检的适应证是什么?
肿瘤破裂是GIST术后复发的独立危险因素,也是强烈的不良预后因素。因此,对于GIST,我们常倾向于避免术前活检,虽然其并不肯定导致肿瘤破裂。对于术前评估能够完整切除且不会明显影响相关直肠肛门功能者,或者是否活检不影响手术切除范围者,可直接手术切除。《中国胃肠间质瘤诊断治疗共识(2017年版)》中对于可完整切除的直肠GIST,术前不推荐进行常规活检。而对于像该病例中肿瘤直径较大、位置较低等情况,为避免联合脏器切除、增加保肛概率而需要进行术前靶向治疗者,应行活检以明确诊断,推荐完善基因检测(至少应包括 c-KIT 基因外显子 9、11、13、17 和 PDGFRA基因外显子12、18),以指导选择靶向治疗药物。对于直肠GIST,建议经肛穿刺活检,以减少肿瘤针道腹腔转移和破裂种植的风险。尽管超声内镜引导下细针穿刺活检是共识推荐的首选活检方式,但由于其存在取材不足的问题,对于合适病例,我们并不排斥空芯针穿刺活组织检查(core needle biopsy,CNB)。本例患者肿瘤较大,经直肠超声引导下行CNB可以获得更多组织,并明确术前病理诊断和基因突变状态,用于指导术前靶向治疗。
(三)直肠GIST术前治疗患者复查频率、疗效评价标准及手术时机选择
在术前分子靶向治疗期间,应定期(每2~3个月)进行动态随访和评估,并推荐使用Choi标准或参考RECIST标准。RECIST标准仅考虑肿瘤体积变化因素,然而大小变化并非治疗反应的唯一参数,结合长径和CT值综合考虑的Choi标准优于RECIST标准,对于治疗早期肿瘤体积缩小不明显甚至增大者,更应优先选择Choi标准。从这一角度来看,增强CT扫描作为疗效评价的手段要优于MRI。另外,首次复查评估肿瘤未缩小时应缩短复查时间,可每月复查一次,以免延误PD的发现,进而错过最佳手术时机。关于术前治疗时限,共识建议伊马替尼术前治疗6~12个月施行手术,以免过度延长术前治疗可能引起的继发性耐药。原则上,如果新辅助治疗反应评估获得可R0切除的机会,或者在药物治疗效果达到最大反应时,应适时行手术切除。在本病例中,患者经伊马替尼治疗后疾病评估为SD状态,无法达到肿瘤缩小降期的目的,更换舒尼替尼治疗后出现PR状态,后再次出现维持SD状态,遂积极采取手术切除。
(四)直肠GIST外科治疗的手术原则和术式选择
迄今为止,对于确诊的直肠GIST,外科手术切除仍是根治的唯一方法,靶向治疗不能替代手术切除。直肠GIST的手术治疗原则为:①完整切除肿瘤,保证切缘组织学阴性(除断端切缘外,直肠GIST切除术还应保证环周切缘阴性);②GIST手术不常规行淋巴结清扫,因此,肠系膜上动脉根部结扎并非必要,结扎直肠上动脉已满足肿瘤学需要;③术中绝对避免肿瘤破裂,必须保护肿瘤假性包膜完整;④直肠GIST很少大范围浸润直肠,在完整切除前提下,尽量行保留直肠的局部切除手术;⑤如直肠GIST与毗邻器官(小肠、子宫、卵巢、膀胱、精囊、前列腺等)紧密粘连或浸润,必要时应将肿瘤连同器官的受累部分整块切除;⑥若未获得R0切除,一般不主张追加手术。外科手术切除直肠GIST面临的最直接的问题是术式的选择,完整切除和整块切除并获得R0切缘是手术切除的目标。直肠GIST位于术野狭小的盆腔内,毗邻诸多重要脏器,因此实现根治性切除的同时实现脏器功能保护有一定难度。切除方式的选择取决于肿瘤的大小、位置以及周围侵犯的程度。伊马替尼出现之前,根治性切除如腹会阴联合切除(abdominoperineal resection,APR)、直肠前切除(anterior resection,AR)为常选方式,但会严重损伤直肠肛门功能,局部切除则可能会增加局部复发的风险。因此,对于直肠尤其是低位直肠GIST,根治性切除与功能保护之间必须谨慎权衡。在靶向治疗时代,局部切除术成为了直肠GIST的主流术式。目前最常用的局部切除方式为经肛切除,包括TEM平台、TAMIS技术等的应用;对于低位直肠后壁的GIST也可采用经骶切除(Kraske术);女性直肠前壁的GIST可采用经阴道切除。但对于高复发风险伴有周围浸润,术前伊马替尼治疗效果不佳的患者,依然需要采取根治性切除方式,如括约肌间切除(intersphincteric resection,ISR)、直肠前切除,如肿瘤距肛缘过近或预计术后肛门功能丧失则应采取腹会阴联合切除。ISR适用于仅侵及内括约肌的GIST,能够在保证R0切除基础上实现肛门功能的最大程度保全。由于直肠GIST极少发生淋巴结转移,因此从肿瘤学角度来说TSME、TME并非必要,一般沿肿瘤假包膜达到R0切除即可,损伤控制性切除可以减少损伤神经血管束、阴道壁、前列腺、尿道的风险。不过从手术学角度来说,沿直肠系膜的解剖间隙分离进行“膜解剖”手术能够显著减少出血。本例患者,由于肿瘤过大、术前影像学评价及术中探查发现肿物与前列腺、肛提肌等结构难以分离,遂行肛提肌外腹会阴联合直肠切除术(ELAPE),以达到R0切除的目的。
(五)术前靶向治疗的治疗反应能否影响术后靶向治疗的决策?
术前治疗反应与术后靶向治疗的药物选择、剂量确定的关系目前尚缺少足够的高级别循证证据,对于此类患者,术后应将复发危险度分级、基因检测结果及术前靶向治疗效果评价相结合,以此来选择术后辅助治疗的方案。本例患者术前经8个月的伊马替尼治疗(SD状态)、4个月的舒尼替尼治疗(PR状态)和5个月舒尼替尼治疗(维持SD状态),且病理学检查结果评价术前治疗效果为PR。术后标本的二代测序结果显示c-KIT外显子9突变,未检测到继发突变情况。一般接受过术前治疗的GIST患者无论术后肿瘤大小、核分裂象情况如何,均应判定为复发风险高危,应继续接受术后辅助治疗。本例高危复发风险患者,术前舒尼替尼治疗较伊马替尼效果明显,且为c-KIT外显子9突变,因此我们推荐术后辅助治疗仍选择舒尼替尼 37.5mg/d治疗,疗程至少3年。
【专家点评】
直肠GIST发病率较低,临床上不容易见到,且常分散就诊于各医疗中心,治疗上欠缺统一的标准和规范,研究也常常受限于样本量,因此关于直肠GIST的诊治有许多问题值得探讨,亟待进一步研究。
直肠GIST常无明显临床表现,当出现症状时,结合直肠指诊、内镜、EUS、经直肠超声、MRI、CT等检查手段,诊断并不困难。由于来源组织层次不同,直肠GIST与直肠癌的鉴别较容易,但与其他类型黏膜下肿物的术前鉴别可能有困难。对于可直接局部切除且不显著影响直肠肛门功能的直肠GIST,建议直接行局部切除;而术前评估直接切除难以获得R0切缘或显著影响直肠肛门功能者,可试行术前靶向治疗,以期达到根治与功能兼顾的双重目标。拟行术前靶向治疗者,应行术前活检以明确GIST诊断、明确基因突变类型。
直肠GIST的治疗,是以外科治疗为主的多学科综合治疗,外科手术完整切除和整块切除直肠GIST是实现治愈的最主要手段。最理想的术式是局部切除术,然而,必要时也要毫不犹豫选择腹会阴联合切除等破坏性大的直肠切除术式,根治是直肠GIST手术的首要目标。直肠GIST由于其特殊的解剖部位,有多种手术入路、途径、手段可供选择,应结合患者具体情况、医者经验和可及设备条件,实施个体化治疗。
通过本病例的诊治,有以下几点值得借鉴。
直肠GIST的诊断并不困难,重要的是早期发现、精确评估,临床医师不应轻视直肠指诊等体格检查的重要性,对于可疑病变,应及时完善相关检查。
直肠GIST拟行术前靶向治疗者,除需活检明确诊断外,行基因检测是必要的,明确突变类型有助于靶向治疗药物的选择和剂量确定,某些基因检测显示原发耐药的直肠GIST可直接决定手术切除。
术前靶向治疗期间应定期(每2~3个月)评估治疗效果,优先选用 Choi标准,在药物治疗效果最大化时,及时手术干预,以免贻误手术治疗的最佳时机。
直肠GIST的外科治疗,原则上首选局部切除术式,但如不能保证R0切除,则必须选择扩大切除术式,手术的目的是治愈,而不是保肛。
免责声明
内容来源于人卫知识数字服务体系、人卫inside知识库,其观点不反映优医迈或默沙东观点。 此服务由优医迈与胤迈医药科技(上海)有限公司授权共同提供。
如需转载,请前往用户反馈页面提交说明:https://www.uemeds.cn/personal/feedback
[1] 中国临床肿瘤学会胃肠间质瘤专家委员会. 中国胃肠间质瘤诊断治疗共识 (2017年版) [J] . 肿瘤综合治疗电子杂志, 2018, 4 (1) : 31-43.
[2] 叶颖江, 高志冬. 直肠胃肠间质瘤综合诊疗模式 [J] . 中国实用外科杂志, 2018, 38 (5) : 508-511.
[3] 姚宏伟, 张忠涛. 直肠胃肠间质瘤不同手术入路的探索: 从TME到TEM再到TaTME [J] . 中国实用外科杂志, 2018, 38 (5) : 578-581.
[4] 李子禹, 李双喜, 季加孚. 胃肠间质瘤术前靶向药物治疗与手术时机选择 [J] . 中国实用外科杂志, 2018, 38 (5) : 494-497.
[5] JAKOB J, HOHENBERGER P. Neoadjuvant Therapy to Downstage the Extent of Resection of Gastrointestinal Stromal Tumors [J] . Visc Med, 2018, 34 (5) : 359-365.
[6] KANEKO M, EMOTO S, MURONO K, et al. Neoadjuvant imatinib therapy in rectal gastrointestinal stromal tumors [J] . Surg Today, 2019, 49 (6) : 460-466.
[7] WILKINSON M J, FITZGERALD J E, STRAUSS D C, et al. Surgical treatment of gastrointestinal stromal tumour of the rectum in the era of imatinib [J] . Br J Surg, 2015, 102 (8) : 965-971.





 Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
