胃肠间质瘤(gastrointestinal stromal tumor,GIST)的起源及发病机制已基本阐述清楚,然而GIST的高复发转移率仍是困扰临床医师的难题。大部分GIST分级标准主要是依据肿瘤大小、核分裂象数以及肿瘤部位为主要参数而制定的,但这些标准尚不能精确地预测GIST的复发概率。学界广泛认为原发灶的大小和核分裂象是判断肿瘤恶性程度和决定术式的重要指标,其中核分裂象占更高的参考权重。临床上在GIST的诊疗过程中发现,肿瘤体积小但核分裂象数目高的情况并不罕见,华中科技大学同济医学院附属协和医院对该类患者进行了单中心的病例回顾,269例肿瘤最大径小于2cm的病例中,有14例伴有高核分裂象,约占5%。此类患者的诊疗应更加重视基因检测和辅助治疗等情况,进行综合评估。
【病例摘要】
患者,男性,49岁。于2016年12月因“间断呃逆3年余,加重6个月”就诊于当地医院。行电子胃镜检查示:慢性糜烂性胃炎伴溃烂;胃体隆起。超声胃镜示:胃体可疑固有肌层低回声隆起。予护胃抗酸治疗,患者呃逆症状好转。患者为明确胃部隆起性病变性质,前往华中科技大学同济医学院附属协和医院胃肠间质瘤专病门诊就诊。门诊以“胃体隆起:胃肠间质瘤?”收治入院。
既往史及家族史
高血压三年余,最高血压180/100mmHg,规律服药,平素血压控制良好;否认食物及药物过敏史;父母已故,家族中无类似病史。
体格检查
腹部平坦,未见胃肠型及蠕动波。腹部外形正常,全腹柔软,无压痛反跳痛,无肌紧张,腹部未触及包块,肝脾肋下未及,肠鸣音正常。
辅助检查
血常规:未见明显异常。
血生化:总胆红素23.2μmol/L↑,直接胆红素 9.4μmol/L↑,总蛋白 49.5g/L↓,球蛋白12.7g/L↓,钠 139mmol/L,钾 3.37mmol/L↓,钙 1.97mmol/L↓,磷 0.83mmol/L↓。
肿瘤标志物:各项指标未见异常。
全腹部三维CT:①胃腔充盈一般,胃底大弯侧可见一软组织密度结节影向腔外突出,直径约1.5cm,考虑胃肠间质瘤;②肝脏大小及形态可,未见明显转移灶;③余腹腔未见明显转移灶(图1)。
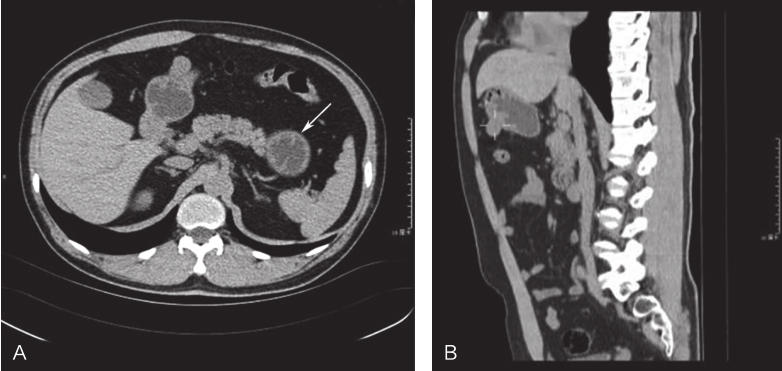
图1 腹部CT提示胃底大弯侧软组织密度影
A.横断位;B.矢状位
引自:胃肠间质瘤典型病例诊治与解析.第1版.ISBN:978-7-117-30146-6.主编:陶凯雄 曹 晖
电子超声胃镜:胃体后壁见一扁平隆起,表面光滑;胃体病灶处见一类圆形低回声病灶,凸向腔外生长,边界清楚,内部回声均质,最大切面1.5cm×1.6cm,起源于固有肌层深层,周边未见肿大淋巴结,超声弹力成像质硬(图2)。

图2 超声胃镜提示胃体低回声病灶,最大切面约1.5cm×1.6cm
A.胃镜;B.超声内镜
引自:胃肠间质瘤典型病例诊治与解析.第1版.ISBN:978-7-117-30146-6.主编:陶凯雄 曹 晖
初步诊断
1.(胃体)胃肠间质瘤
2.慢性浅表性胃炎伴糜烂
3.高血压3级 很高危
【治疗过程】
(一)病例分析
患者为中年男性,以“发现胃部隆起”就诊。术前检查完善,目前诊断为:(胃体)胃肠间质瘤。影像学检查示肿瘤大小约1.5cm,边界清楚,未见明显转移灶。根据《胃肠间质瘤规范化外科治疗专家共识(2015年版)》,该患者为大小<2cm的局限型胃GIST,影像学检查无不良因素,可定期内镜或影像学随访,严密观察。与患者及家属沟通治疗方案,患者与家属要求行外科手术治疗。
(二)治疗方案
于2016年12月行“腹腔镜联合胃镜下胃肿物局部切除术”,术中先行胃镜定位后再行腹腔镜准备,可见胃体后壁近胃窦处一直径1cm隆起性病变,肝脏及其他脏器未及明显异常,遂行胃肿物局部切除术,手术过程顺利。
(三)术后病理
术后病理:①(胃体)胃肠间质瘤(肿块大小2.0cm×1.5cm;梭形细胞为主;核分裂象>10个/50HPF;改良NIH危险度分级:高危);②胃体手术切缘切片上未见肿瘤累及,胃小弯侧淋巴结(5枚)、大弯侧淋巴结(6枚)切片上未见肿瘤组织转移(图3)。
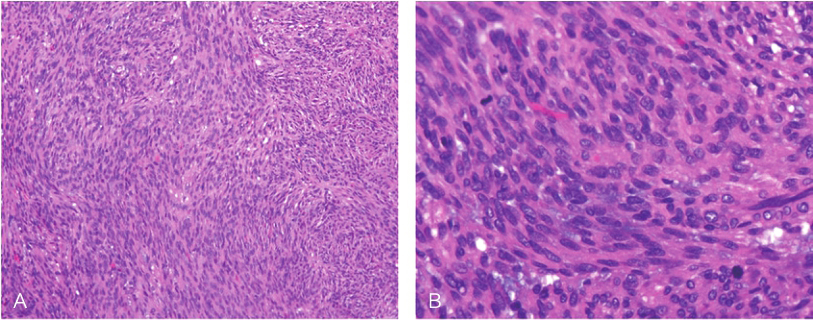
图3 术后病理HE染色
A.100×;B.400×
引自:胃肠间质瘤典型病例诊治与解析.第1版.ISBN:978-7-117-30146-6.主编:陶凯雄 曹 晖
免疫组织化学染色:CD117(+),CD34(+),DOG-1(+),SMA(-),S-100(-),Ki-67(>10%)。
基因检测:患者拒绝。
【预后】
患者于术后第11天恢复出院。术后27天开始伊马替尼靶向治疗,400mg/d。截至2019年6月,随访29个月,患者无明显不良反应,未发现明显肿瘤复发转移迹象。
【经验与体会】
(一)(胃)小GIST是否手术治疗更好?
外科手术切除是GIST最主要和最有效的治疗手段,但并非所有胃部的小GIST都适合手术治疗。目前学界针对胃GIST的手术治疗的肿瘤大小截点存在着争议,部分学者支持较小的胃GIST(<2cm)不用手术治疗,仅需定期复查,当发现疾病进展时再进行手术也能取得很好疗效。根据《胃肠间质瘤规范化外科治疗中国专家共识(2018版)》,<2cm的胃GIST,伴随临床症状者,可考虑手术治疗;无症状的拟诊GIST,应根据其内镜和内镜超声表现确定是否具有进展风险。内镜超声下的不良因素为边界不规整、溃疡、内部强回声和异质性。对于无不良因素的患者,可定期进行内镜或影像学随访。
本例中患者因发现胃部隆起就诊,考虑胃GIST可能性大,肿瘤原发于胃体,肿瘤大小较小,胃镜超声下无不良因素,根据指南可暂不行手术切除,定期影像学随访。与患者及家属沟通后,患者表明手术意愿故行手术治疗。但术后病理发现该患者核分裂象>10个/50HPF,根据改良NIH危险度分级为高度复发风险患者。对于该患者而言,手术治疗获益更大。因此对于小的胃GIST要参照各项指南,综合分析各项检查指标慎重决定是否行手术治疗,如何甄别不同复发风险的小GIST值得我们进一步探讨。
(二)小GIST是不是都适合内镜下切除?
胃肠间质瘤手术方式的选择一直是学界讨论的热点。应用各种内镜技术以及双镜联合技术治疗GIST是近几年才提出来的治疗方案。对于如何为患者选择适合的治疗方式,目前还存在争议。虽然不同中心都有关于内镜及双镜联合技术治疗GIST的报道,但是都存在样本量较小和随访时间较短的问题。所以在选择治疗方案时,要全面考虑肿瘤的大小、部位、生长方向、浸润情况和切除后功能影响等多个因素,内镜下切除以及双镜联合技术等应在经验丰富的内镜中心进行。
根据《胃肠间质瘤规范化外科治疗中国专家共识(2018版)》,位于食管远端的GIST,根据大小、位置和性质,在有经验的单位可以开展内镜下剜除术、经黏膜下隧道内镜切除及经左开胸肿瘤切除等不同术式。
(三)体积越小的胃GIST预后会更好吗?
目前认为,原发灶的大小和核分裂象是判断肿瘤恶性程度和选择手术术式的重要指标,但任何单一因素均不能可靠地对复发风险进行评估。现有指南并不能准确评估肿瘤体积小但核分裂象数目高的GIST预后情况,2016年美国国立综合癌症网络(NCCN)指出,直径<2cm 的GIST,即使合并高核分裂象数,转移或肿瘤相关死亡率也不足4%;华中科技大学同济医学院附属协和医院长达13年的随访研究也发现,本中心14例体积小、核分裂象数目高的患者术后均没有复发。而有少数文献报道这类病例预后相对较差,复发风险甚至和高危组类似。因此评价此类胃肠间质瘤的预后应参考各类指南,综合各项参数,如基因检测和辅助治疗效果,进行系统性评估。
【专家点评】
NCCN指南将胃来源直径小于2cm的GIST定义为“小GIST”,该类型的GIST作为一组特殊的分类主要源于其独特的生物学行为。随着人们健康意识的提高,以及影像学、内镜技术的发展,近年来其发病率逐渐升高。鉴于此,该类肿瘤值得引起大家的关注。
不论NCCN指南,还是我国的专家共识,对于小GIST的治疗推荐均是:如果超声内镜下没有高风险特征(如不规则边界、囊性空腔、溃疡、强回声病灶和异质性),患者只需每6~12个月进行一次超声内镜复查随访,无需接受手术治疗。但该推荐在临床操作实践中存在一定的干扰因素,包括①超声内镜检查具有主观性,诊断准确性受操作医生的影响较大;②患者对于疾病的焦虑严重影响生活质量,且随访的时间、经济成本以及患者的依从性往往导致不能完全按照指南推荐的方式进行随访;③随着微创技术的发展,部分外科医生认为可以通过微创手术治疗的方式彻底切除病灶,代价相对较小。而更为重要的原因在于,并非所有的小GIST均为良性生物学行为表现,笔者回顾性分析了来自CN-GIST(广东省人民医院,华中科技大学同济医学院附属协和医院,中山大学附属肿瘤医院,南方医科大学南方医院)1998年至2015年间接受了手术治疗(内镜或手术)的小GIST数据共计273例,发现根据改良NIH危险度分级诊断标准,中危患者为7例(2.5%),高危患者为10例(3.6%)。
目前,尚不推荐内镜技术用于小GIST的治疗,但不可否认该技术的微创性,尤其是肿瘤位于贲门等特殊部位,该技术可最大限度地保留功能,因此笔者认为在具备一定技术条件的单位可将内镜技术作为临床研究项目开展。而腹腔镜技术目前无疑是治疗小GIST的主流治疗方案,传统腹腔镜技术进行楔形切除即可完成大部分小GIST的治疗。对于特殊部位的GIST(贲门附近),笔者团队开展了腹腔镜经胃腔贲门肿瘤切除,取得了良好的疗效,推荐有经验的医疗中心可针对特殊部位肿瘤开展此技术。
根据改良NIH危险度分级标准,给予小GIST患者相应的术后辅助治疗及随访。
免责声明
内容来源于人卫知识数字服务体系、人卫inside知识库,其观点不反映优医迈或默沙东观点。 此服务由优医迈与胤迈医药科技(上海)有限公司授权共同提供。
如需转载,请前往用户反馈页面提交说明:https://www.uemeds.cn/personal/feedback
[1] MIETTINEN M, MAKHLOUF H, SOBINL H, et al. Gastrointestinal stromal tumors of the jejunum and ileum: aclinicopathologic, immunohistochemical, and molecular genetic study of 906cases before imatinib with long-term follow-up [J] . American Journal ofSurgical Pathology, 2006, 30 (4) : 477-489.
[2] CHIEN C H, CHIEN R N, YEN C L,et al. The Role of Endoscopic Ultrasonography Examination for Evaluation andSurveillance of Gastric Subepithelial Masses [J] . Chang Gung Med J, 2010, 33(01) : 73-81.
[3] 沈坤堂, 高晓东. 小和微小胃肠间质瘤的评估与内镜治疗 [J] . 中华胃肠外科杂志, 2015 (4) : 328-331.
[4] 叶颖江, 高志冬, 王杉. 小胃肠道间质瘤的诊断和治疗策略 [J] . 中华消化外科杂志, 2013, 12 (4) :245-248.
[5] 李冰, 齐志鹏, 周平红, 等. 内镜全层切除术治疗胃底部小及微小胃肠间质瘤价值探讨 [J] . 中国实用外科杂志, 2017, 37 (11) : 1281-1285.
[6] VON MEHREN M, RANDALL R L,BENJAMIN R S, et al. Soft Tissue Sarcoma, Version 2. 2018, NCCN ClinicalPractice Guidelines in Oncology [J] . J Natl Compr Canc Netw, 2018, 16 (5) :536-563.





 Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
