内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)是以内镜黏膜切除术(endoscopic mucosal resection,EMR)为基础,通过在黏膜下注射含有染色剂的生理盐水,利用几种特殊的高频电刀将病灶周围黏膜切开,再将病灶完整剥离,达到治愈目的的技术。内镜下黏膜剥离术等内镜微创手术最大的优点在于不破坏胃壁结构的完整性,对于病灶位于贲门及胃窦的胃肠间质瘤患者,可有效降低病灶切除后狭窄的发生概率。
【病例摘要】
患者,女性,68岁,2016年10月因“腹痛1周”就诊于当地医院。行胃镜检查示:①胃底肿瘤;②糜烂性胃炎。当地医院给予抗炎和护胃等对症支持治疗。为求进一步治疗,患者于2016年11月至华中科技大学同济医学院附属协和医院胃肠外科门诊就诊,行超声胃镜检查示(图1):贲门大弯侧可见一隆起性病变,表面黏膜光滑,边界尚清,肿块内部回声均匀,病灶最大切面约2cm×2cm,包膜完整,起源于固有肌层,凸向腔内生长,胃肠间质瘤?门诊以“胃底占位性病变:胃肠间质瘤?”收治入院。
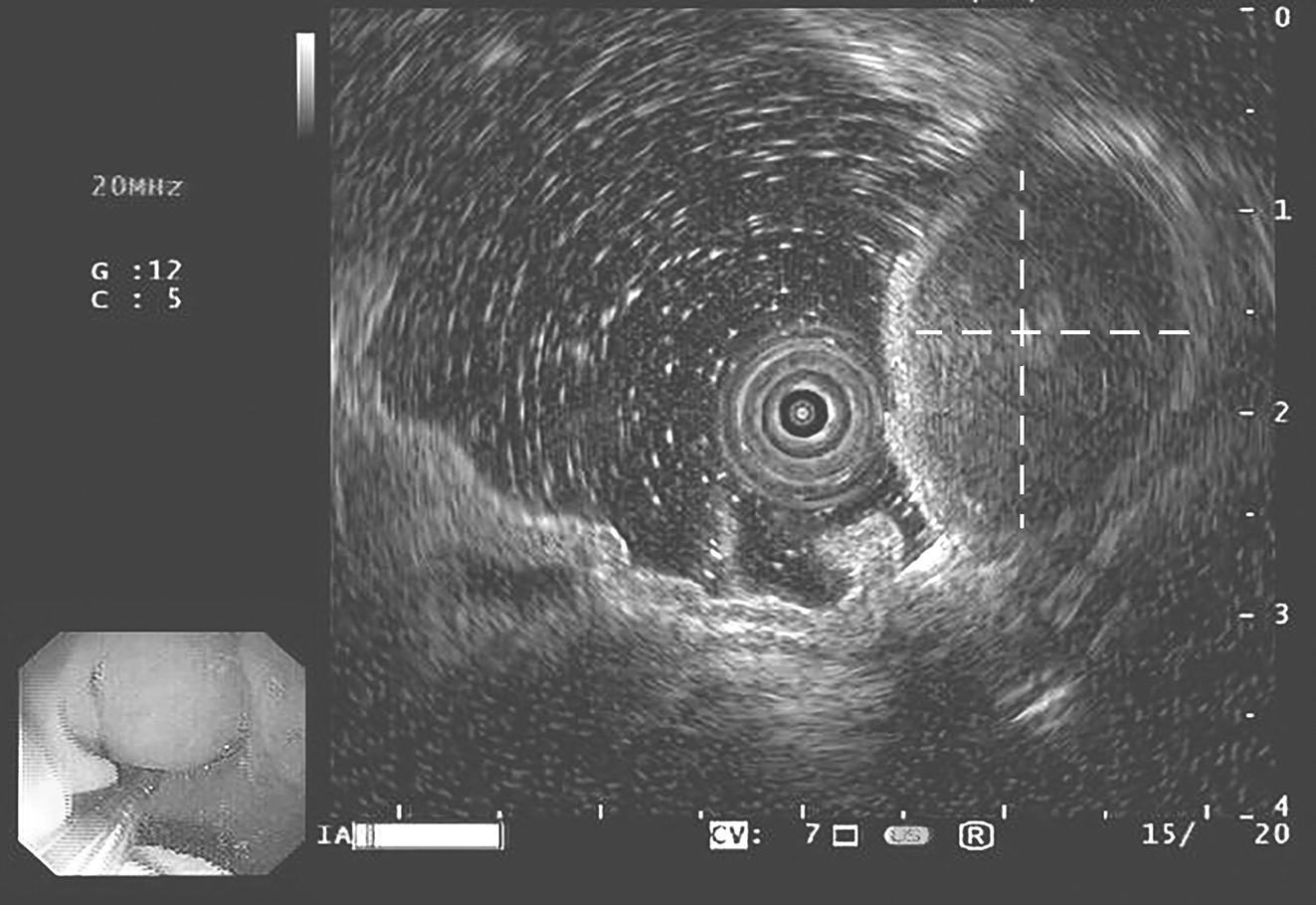
图1 超声胃镜检查
既往史及家族史
既往体健,否认药物过敏史;父母已故,家族中无类似病史。
体格检查
腹部平坦,未见胃肠型及蠕动波。腹部无压痛,无反跳痛,无肌紧张;未触及腹部包块,移动性浊音阴性,肠鸣音正常。
辅助检查
血常规:白细胞 3.77×109/L,红细胞 3.66×1012/L ↓,血红蛋白 119g/L,血小板 248×109/L,中性粒细胞百分比52.60%,淋巴细胞百分比41.1%;
血生化:未见明显异常;
肿瘤标志物:未见明显异常;
2016年11月腹部CT平扫(图2):贲门处见结节状软组织密度影凸向胃腔内,呈等密度影,大小约1.8cm×1.7cm,边缘尚光整,胃周脂肪间隙尚清,未见明显肿大淋巴结影,考虑为胃肿瘤性病变,胃肠间质瘤可能;余无异常。
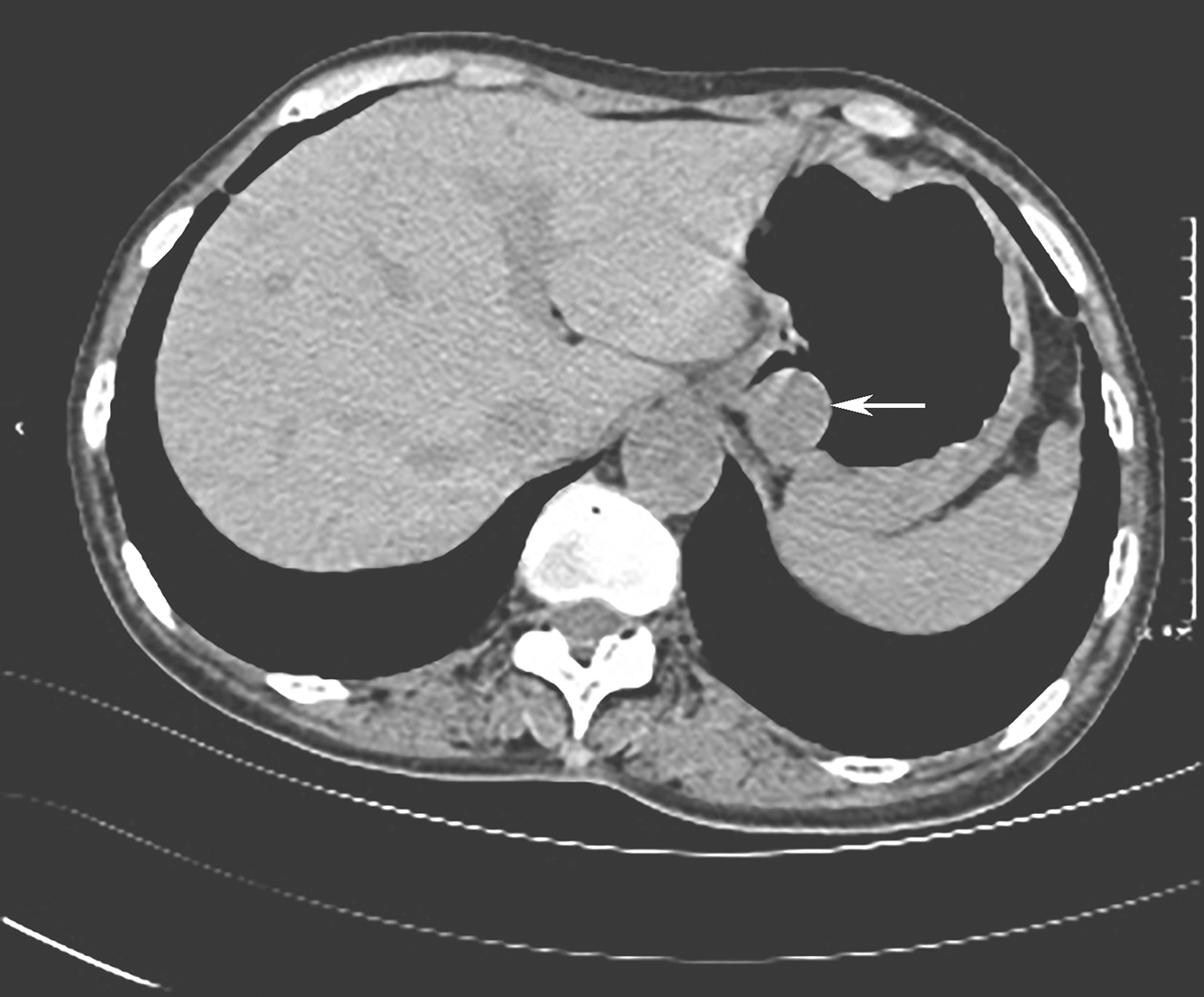
图2 腹部CT示贲门处占位,GIST可能
初步诊断
1.胃贲门占位性病变:胃肠间质瘤?
2.糜烂性胃炎
【治疗过程】
(一)病例分析
患者为老年女性,以“腹痛1周”就诊。初步诊断:(贲门)胃肠间质瘤?肿块位于胃底近贲门处,大小约2cm×2cm。根据《中国胃肠间质瘤诊断治疗共识(2017年版)》,对于食管胃结合部等特殊部位的胃肠道间质瘤(gastrointestinal stromal tumors,GIST),一经发现应积极性手术治疗,以免肿瘤增大,导致保留贲门功能的手术难度增加。考虑到肿瘤位置特殊,腹腔镜下使用切割吻合器械易导致术后贲门狭窄,故行内镜下胃底隆起性病变剥除术。
(二)治疗方案
于2016年11月行“内镜下胃底隆起性病变剥除术”。患者全身麻醉后,行内镜探查病灶,于贲门大弯侧见一直径约2cm隆起病变。手术步骤如下:①使用氩离子凝固术(APC)对病灶边缘进行标记;②将靛胭脂、肾上腺素和生理盐水混合配成溶液,多点黏膜下注射于病灶边缘标记点外侧;③使用针刀沿APC标记点切开肿瘤表面黏膜,显露黏膜下肿瘤;④使用一次性黏膜切开刀沿肿瘤与固有肌层的连接处进行剥离,完整剥离肿瘤,取出后送病理检查(图3)。创面未见明显穿孔,电凝止血后未见明显活动性出血。手术时间85min,出血量约为10ml。
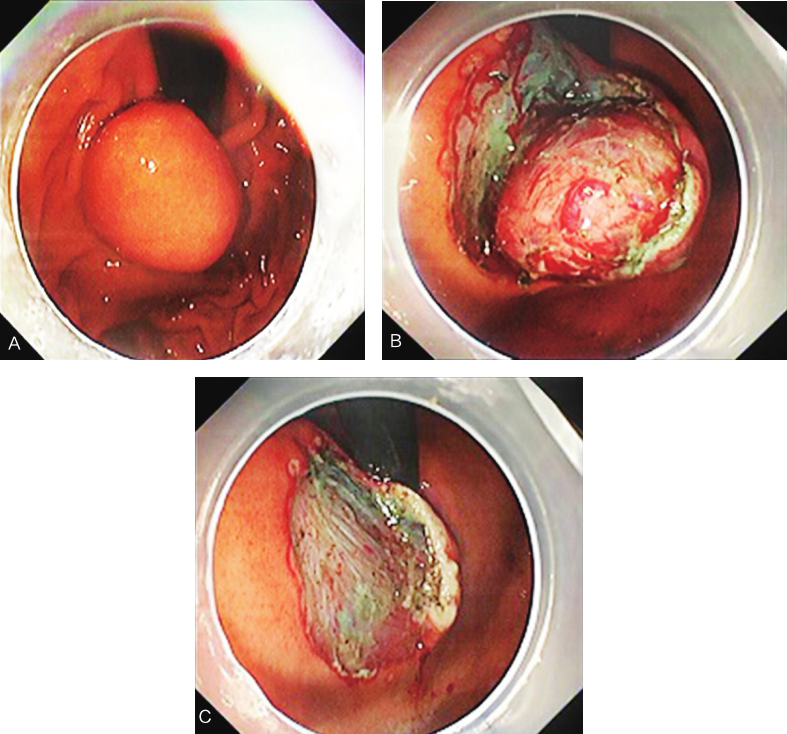
图3 ESD操作下显露黏膜下肿瘤
(三)术后病理及基因检测
病理诊断:(贲门)胃肠间质瘤(2cm×1.8cm×1cm),核分裂象:7个/50HPF,依据改良NIH危险度分级:中危。
免疫组织化学染色:CD117(+),CD34(+),DOG-1(+),SMA(-),S-100(-),Ki-67(Li<5%)。
基因检测:患者因经济原因,拒绝行基因检测。
【预后】
患者术后第1天禁食,第2天无出血和腹痛,进流质饮食。第3天进食半流质饮食无异常后出院。术后因经济原因未行辅助治疗。截至2018年11月,随访24个月,患者无复发生存。
【经验与体会】
本例患者肿瘤位置特殊,若行传统的手术切除肿瘤,破坏贲门功能难以避免。贲门切除往往会带来包括胃食管反流在内的多种并发症,将影响患者的生活质量。行ESD术后,本例患者未出现贲门狭窄、食管反流等并发症,术后随访20个月,患者无病生存。提示在经验丰富的中心严格把握适应证的前提下开展GIST的内镜下切除是安全有效的。参考食管胃结合部(esophagogastric junction,EGJ)腺癌的Siewert标准及国内外研究报道,大多数学者将位于贲门上2cm至贲门下2cm以内的GIST定义为EGJ胃肠间质瘤。由于EGJ管腔狭窄且转角陡急,特殊的解剖结构使得内镜下切除肿瘤存在困难,甚至可能引起术后并发症发生率升高。因此,EGJ以往被认为是内镜手术的禁区。且贲门切除往往引起严重的胃食管反流,使得患者术后生存质量急剧下降。因此,为了提高患者术后生存质量,复旦大学附属中山医院对20余例EGJ胃肠间质瘤患者行ESD,完整切除率为100%,术后患者均未出现消化道狭窄及反流等并发症。随访3~36个月,患者均无局部复发和远处转移。浙江大学医学院附属第一医院对14例EGJ胃肠间质瘤行ESD,完整切除率为100%,均未出现消化道狭窄和反流等并发症,术后随访12个月,均未出现肿瘤复发转移。
对于直径小于2cm的无症状拟诊胃GIST,如超声内镜下不合并边界不规整、溃疡、强回声及异质性等不良因素,可考虑定期(6~12个月)复查超声内镜;如合并不良因素,或者伴出血和腹痛等临床症状,则应考虑切除。对于直径大于2cm的局限性胃GIST,处理方式如下:①评估无手术禁忌证,能达到完整切除者,可直接行手术切除;②临界可切除或虽可切除但手术风险较大、需要行联合脏器切除或严重影响脏器功能者,术前宜先行伊马替尼治疗,待肿瘤缩小后再考虑手术治疗。2017版CSCO指南指出内镜下ESD切除GIST缺乏中长期安全性的大样本量对比研究,故不作为常规推荐。随着内镜技术的发展,内镜下ESD成功切除GIST报道的不断增多,《中国消化道黏膜下肿瘤内镜诊治专家共识(2018版)》指出,内镜黏膜下剥离术适用于直径≥2cm的黏膜下肿瘤(submucosal tumor,SMT)。
ESD严重并发症虽然少见,但是一旦发生会严重影响患者的预后与生存质量,应引起内镜医师的警惕。ESD的常见并发症包括:①出血:发生率约为7%,大部分可在内镜下处理。Kim等发现ESD术后出血的高危因素包括:患者年龄<65岁、病变直径>15mm、内镜操作医师工作经验<5年。此外,术后迟发性出血与肿瘤病变部位密切相关,如病变位于胃中、下1/3时,其出血发生率显著高于胃部上1/3的病变。②穿孔:发生率为3.5%~4%。胃穿孔的高危因素有:病变位于胃体中上部,病变合并溃疡及瘤体过大。肿瘤残留,术后切缘阳性主要由术前未明确肿瘤边界引起,术前标记、设计切除范围可降低病灶残留及局部复发的概率。③狭窄:ESD术后狭窄发生率较低。文献报道术后狭窄的病例均是由于黏膜切除范围过大所致,好发于胃窦。
免责声明
内容来源于人卫知识数字服务体系、人卫inside知识库,其观点不反映优医迈或默沙东观点。此服务由优医迈与胤迈医药科技(上海)有限公司授权共同提供。
如需转载,请前往用户反馈页面提交说明:https://www.uemeds.cn/personal/feedback
人卫知识数字服务体系





 Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
