胃肠间质瘤(gastrointestinal stromal tumor,GIST)的分级标准直接影响着GIST治疗策略的选择,前期的GIST分级标准主要是依据肿瘤大小、核分裂象数、肿瘤部位以及肿瘤破裂等主要参数而制定的,但这些标准尚不能精确地预测GIST的复发概率。目前学界普遍认可核分裂象权重较高,现有的改良NIH危险度分级不能对患者复发及预后提供个体化依据,尤其忽视了高核分裂象患者的预后。由此可以看出,仅仅依靠肿瘤常规的病理特征,对GIST进行危险度分级显然是不够的。理想评估标准的最终目的是揭示GIST的生物学本质并用以指导临床合理的治疗。目前诸多评估标准尚不能合理预测GIST复发风险,从而使得临床治疗面临一定困境,尤其是对于那些具有极高复发风险的患者。
【病例摘要】
患者,女性,64岁。于2015年9月因“黑便伴上腹不适半月余”就诊于当地医院。电子胃镜检查示:胃体巨大溃疡(胃癌可能)并胃窦隆起性病变。患者为求进一步诊疗,遂前往华中科技大学同济医学院附属协和医院就诊,门诊以“胃占位性病变”收入。
既往史及家族史
既往体健,否认食物及药物过敏史;父母健在,家族中无类似病史。
体格检查
生命体征平稳,贫血貌,皮肤黏膜无黄染。腹部平坦,未见胃肠型及蠕动波。腹部外形正常,全腹柔软,无压痛反跳痛,无肌紧张,膈下可触及一实性包块,质软,移动度差,肝脾肋下未及;肠鸣音正常。
辅助检查
血常规:白细胞 9.21×109/L,红细胞 2.82×1012/L↓,血红蛋白 77g/L↓,血小板 495×109/L↑,中性粒细胞百分比 78.9%↑,淋巴细胞百分比 15.5%↓。
血生化:各项指标未见异常。
肿瘤标志物:未见异常。
电子超声胃镜:内镜下见胃体小弯侧巨大溃疡,底覆污秽苔,超声扫描显示胃体小弯侧巨大低回声占位病灶,病灶大部分凸向腔外,切面大小约8cm×8cm,与肝脏界限清晰,腹腔内未见明显肿大淋巴结(图1)。
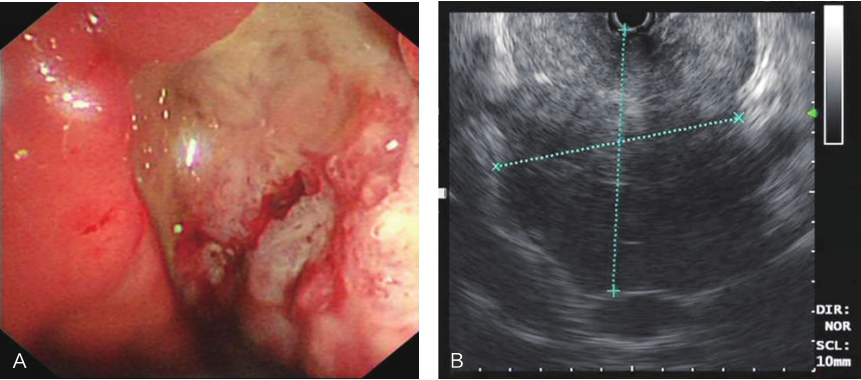
图1超声胃镜提示胃体小弯侧巨大低回声病灶,切面约8cm×8cm
A.胃镜;B.超声内镜
引自:胃肠间质瘤典型病例诊治与解析.第1版.ISBN:978-7-117-30146-6.主编:陶凯雄 曹 晖
上腹部增强CT:肝胃间隙见大小约11.2cm×11.4cm软组织肿块影,呈多发分叶状,密度不均,考虑间叶源性肿瘤可能性大(图2)。
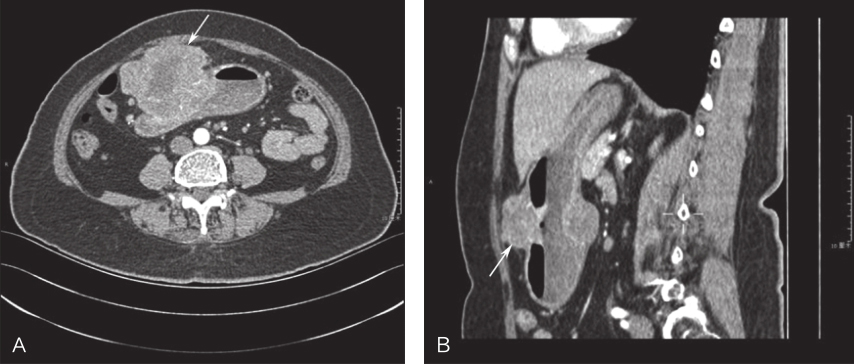
图2腹部CT提示肝胃间隙巨大分叶状软组织肿块影
A.横断位;B.矢状位
引自:胃肠间质瘤典型病例诊治与解析.第1版.ISBN:978-7-117-30146-6.主编:陶凯雄 曹 晖
初步诊断
1.胃恶性肿瘤:胃肠间质瘤?
2.消化道出血
3.中度贫血
【治疗过程】
(一)病例分析
患者为中老年女性,以“黑便伴上腹部不适”就诊。目前诊断考虑:(胃)胃肠间质瘤。影像学检查示肿瘤位于胃体小弯侧,瘤体较大,专科讨论考虑到:①患者黑便症状较重,中度贫血;②内镜检查见肿瘤表面破溃;③肿瘤组织与周围组织界限清晰,腹腔内未见明显肿大淋巴结,下一步进行手术治疗,综合肿瘤部位、大小等因素,开放手术更合适。患者中度贫血,一般情况尚可,ECOG评分2分,NRS(2002)评分4分,故行肠内营养支持,纠正贫血后立即行外科手术治疗。
(二)治疗方案
于2015年9月行剖腹探查,术中探查见:胃大弯靠近幽门处一大小约13cm×12cm的巨大肿块,形状不规则,呈明显分叶状,未见明显转移灶。遂行“远端胃切除术+区域淋巴结清扫”,术中失血约200ml,手术过程顺利。
(三)术后病理
术后病理:①(远端胃)胃肠间质瘤(肿块大小:13cm×9cm,呈分叶状,细胞异型性明显),局部出血坏死;核分裂象:85个/50HPF;改良NIH危险度分级:高危。②胃体及幽门手术切缘切片上未见肿瘤累及,胃小弯侧淋巴结(12枚)、大弯侧淋巴结(12枚)切片上未见肿瘤组织转移(图3)。
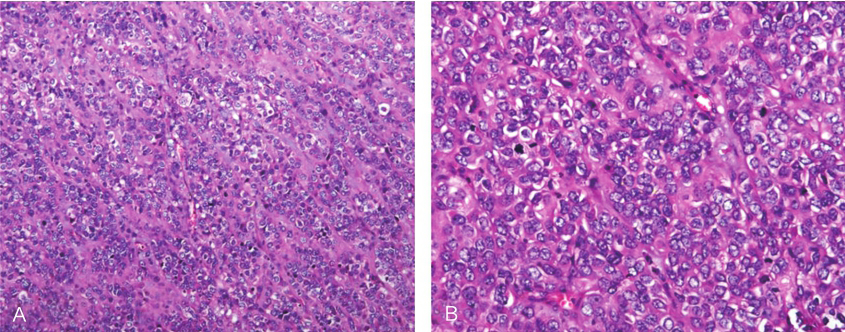
图3术后病理HE染色
A.HE 100×;B.HE 200×
引自:胃肠间质瘤典型病例诊治与解析.第1版.ISBN:978-7-117-30146-6.主编:陶凯雄 曹 晖
免疫组织化学染色:CD117(+),CD34(局灶+),DOG-1(+),SMA(-),S-100(-),Ki-67(Li:30%)(图4)。
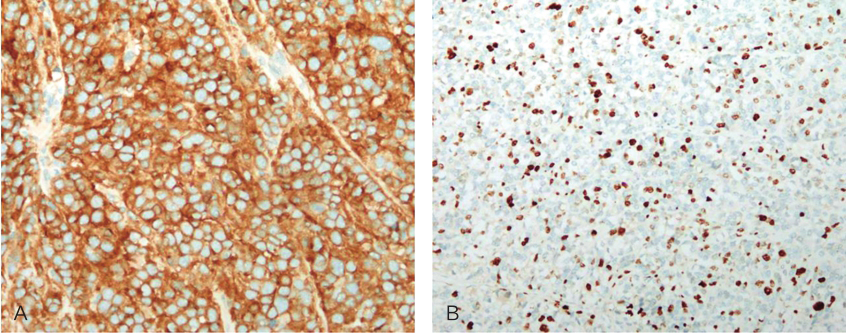
图4术后病理免疫组织化学染色
A.CD117(+)200×;B.Ki-67 100×
引自:胃肠间质瘤典型病例诊治与解析.第1版.ISBN:978-7-117-30146-6.主编:陶凯雄 曹 晖
基因检测:c-KIT基因外显子11发生突变,突变类型为1702_1728del27。
【预后】
患者于术后第13天恢复出院。术后第14天给予伊马替尼靶向治疗,400mg/d。截至2019年6月,随访45个月,患者服药期间出现水肿、白细胞减低(2度)等不良反应,未行特殊治疗,症状缓解,复查全腹部增强CT未发现明显肿瘤复发转移迹象(图5)。
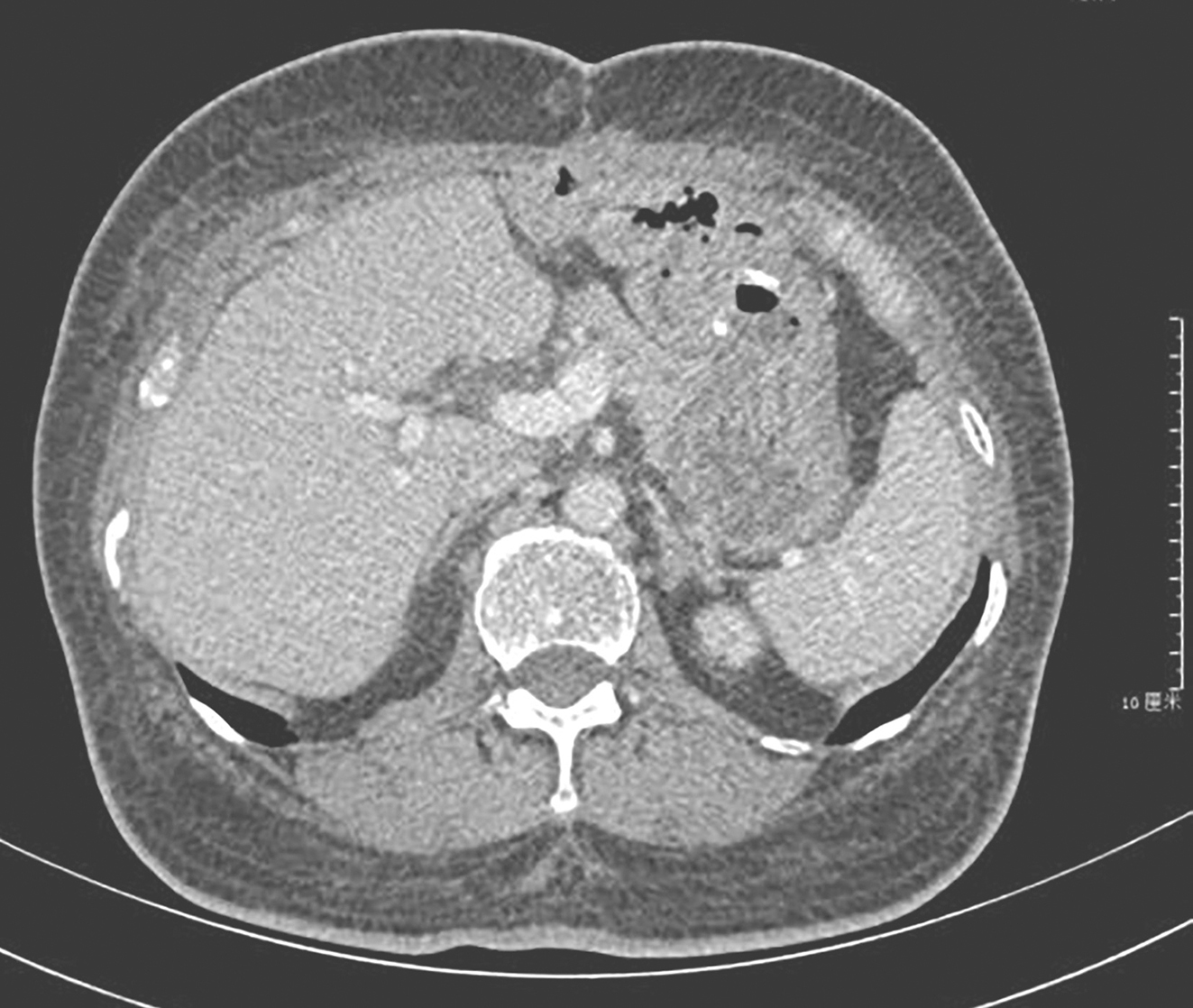
图5术后45个月复查CT
引自:胃肠间质瘤典型病例诊治与解析.第1版.ISBN:978-7-117-30146-6.主编:陶凯雄 曹 晖
【经验与体会】
(一)“极高危”胃肠间质瘤的认识
越来越多的临床医师意识到,现有的GIST危险度分级标准仍有缺陷,并不能很好地指导临床实施个体化治疗。有学者根据核分裂象对高危患者进行了亚组分析,发现核分裂象越高,患者预后更差。更加暴露了现有分级标准缺乏对于患者个体化指导的缺陷。
近年来,基于前期的临床研究结果及分级标准,国外学者从高危GIST中分出了一类具有极高复发风险的患者,称为极高危GIST,其具有恶性程度高、极易发生复发或转移的特性,这类GIST患者更应该引起临床医师的关注。
(二)高核分裂象患者伊马替尼辅助治疗的疗程该如何选择?
伊马替尼用于GIST的辅助治疗后,明显延长了GIST患者术后无复发生存期。然而,3年的辅助治疗并不能保证GIST患者的长期生存获益,仍有部分患者在停药后2年内复发。目前认为,长期使用伊马替尼能有效预防敏感突变患者在治疗期间复发,伊马替尼辅助治疗3年与5年的随机对照试验正在进行。辅助治疗的时间有不断延长的趋势,对于高危复发风险的患者,合适的辅助治疗时间需要根据患者各项信息,重视基因分型实施个体化方案。
所以关于GIST术后的辅助治疗疗程,迄今为止国际上尚未达成统一的意见。对GIST而言,最佳辅助治疗疗程目前仍在探索中,兼顾肿瘤的恶性特征及基因亚型,实施更精准的个体化诊疗才是未来的趋势和方向。
【专家点评】
肿瘤大小、部位、核分裂象及肿瘤是否破裂等指标是影响GIST预后的重要因素。目前,用于判断GIST术后复发危险度的常用标准包括改良NIH危险度分级,AFIP标准以及等高热线图等,其中,改良NIH危险度分级应用最为广泛。
近年来,随着对GIST的了解越来越深入,极高危GIST逐渐成为国内外学者关注的焦点。2015年Maki等学者提出,极高危GIST的特征应至少包含以下标准一项:①肿瘤直径>10cm;②核分裂象数>10/50HPF;③肿瘤直径>5cm以及核分裂象数>5/50HPF;④术前及术中肿瘤破裂。但事实上,此类标准并不全面,未纳入基因突变类型,也未包含极高核分裂象的患者,其预测能力有限。因此,建立包含基因突变类型、核分裂象、大小、部位等项目的更精准的GIST预测模型是目前亟待解决的问题。
免责声明
内容来源于人卫知识数字服务体系、人卫inside知识库,其观点不反映优医迈或默沙东观点。 此服务由优医迈与胤迈医药科技(上海)有限公司授权共同提供。
如需转载,请前往用户反馈页面提交说明:https://www.uemeds.cn/personal/feedback
[1]FLETCHER C D, BERMAN J J, CORLESS C, et al. Diagnosis of gastrointestinal stromal tumors: A consensus approach [J] . Human Pathology, 2002, 33 (5) : 459-465.
[2]李健, 党运芝, 高静, 等. 延长伊马替尼辅助治疗时间对中高度复发肠间质瘤的疗效观察 [J] . 中华胃肠外科杂志, 2013, 16 (3) : 216-220.
[3]史恩溢, 侯英勇, 谭云山, 等. 局限性胃肠道间质瘤危险程度分级标准的应用与评价 [J] . 中华病理学杂志, 2007, 36 (10) : 649-653.
[4]张云, 曹晖. 分子靶向治疗胃肠间质瘤的进展 [J] . 中华消化外科杂志, 2009, 8 (6) : 478-480.
[5]沈朝勇, 张波. 对极高危胃肠间质瘤的认识 [J] . 中华胃肠外科杂志, 2016, 19 (11) : 1226-1229.
人卫知识数字服务体系





 Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
