一、神经内镜发展简史
1910年,Victor D. Lespinasse最先报道了在颅内使用内镜技术治疗脑积水。Dandy在此基础上又做了进一步的拓展和应用,由此,Dandy也被称为神经内镜之父。在20世纪20年代,因为脑积水治疗方法单一,缺少其他选择,所以神经内镜技术在脑积水治疗上得以广泛应用。在内镜下从烧灼、切除脉络丛的基础上,逐渐发展为脑室与蛛网膜下腔的造瘘手术等。1923年,Mixter首次报道了内镜下三脑室造瘘术,一度成为那个年代治疗脑积水的主要方法。1949年,Nulsen和Spitz首次使用带阀门的分流管进行脑脊液分流术,由于此技术的普及和推广,内镜技术在脑积水领域的应用出现停顿,人们对神经内镜的兴趣逐渐下降。直到1960年,柱状透射内镜的发明,其良好的照明和图像分辨率为内镜应用于颅脑手术创造了更好的条件。
实际上,最早将内镜技术广泛应用到临床各类疾病治疗的是耳鼻喉科医生,他们在20世纪60~70年代,已经在鼻窦手术中将应用内镜技术作为标准的治疗手段,为内镜技术的普及和推广做出了重要贡献。由于内镜可提供清晰放大的视野,同时可以观察到显微镜所不能观察到的结构,可以通常获得更好的疗效,也促使一些神经外科医生不断探索应用神经内镜技术进行神经外科疾病的手术治疗。
颅内和颅底内镜手术的先行者,Gerard Guiot于1962年完成了经唇下蝶窦入路神经内镜下垂体腺瘤切除术,但因视野不佳,他后来放弃了该技术。1973年,日本的Fukushima及其同事引进新型神经内镜,用于脑室内病灶活检、囊肿开窗和脑积水的治疗。随后Guiot再次在经蝶窦入路手术中应用内镜,积累了丰富的经验。1978年,Bushe和Halves报道在垂体腺瘤手术中使用新型内镜。但在20世纪70年代,由于手术显微镜的普及和广泛应用,显微技术得到蓬勃发展,成为经蝶窦入路手术的主流,内镜技术成为辅助手段。
20世纪90年代中期,埃及的耳鼻喉科医师Gamea和神经外科医师Fathi,共同报道了10例内镜辅助下垂体腺瘤切除术,取得良好疗效,这种方法也被称为“内镜辅助的经蝶窦入路手术”。随着内镜辅助技术经验的不断积累和改进,逐渐发展成为只应用内镜进行手术操作,也被称为“单纯内镜经蝶窦入路手术”。在单纯内镜手术的发展和推广方面,匹兹堡大学医学中心的神经外科医生Hae Dong Jho和耳鼻喉科医师Ricardo Carrau做出了重要贡献。这两位医师应用单纯内镜技术进行经蝶窦入路手术,无需手术显微镜及鼻牵开器,被公认为纯内镜经蝶窦入路手术的先驱。他们开始时也是应用内镜作为手术显微镜的辅助,后来逐渐发展为纯内镜下操作。1997年,他们报道了50例纯内镜下手术治疗垂体腺瘤患者的结果。在此期间,意大利Naples的Paolo Cappabianca和Enrico de Divittis也报道了纯内镜下手术治疗垂体腺瘤的结果,并开发了专业的内镜手术器械。在此之后,“内镜经鼻入路手术”(endoscopic endonasal approach,EEA)在世界范围内逐渐普及和推广,成为鼻窦及垂体腺瘤手术的成熟治疗方案。
进入21世纪,美国的Kassam、Gardner、Schwartz等将内镜经鼻入路手术扩展应用到整个中央颅底区,用来处理鞍内、鞍上、斜坡、鞍旁的病变。此后,“内镜经鼻入路手术”的概念已经扩展到“扩大内镜经鼻入路手术”(extended endoscopic endonasal approach,EEEA)。EEEA是指利用鼻腔鼻旁窦与邻近颅底结构的关系,扩大切开额窦、上颌窦、筛窦、蝶窦,显露前颅底、眶内侧壁、鞍结节、鞍底、斜坡、海绵窦、齿状突等中线颅底的结构,同时向侧方扩展至翼颚窝、颞下窝为主的侧颅底结构。随着内镜解剖知识的发展、颅底重建技术的提高、颅底修补材料的更新和内镜及辅助设备的不断更新,EEEA必将发挥更大作用。
国内神经内镜的发展与国外相似。20世纪60、70年代,最早也是耳鼻喉科医生将内镜技术广泛应用在鼻窦的各类手术中。20世纪末,陆续出现应用神经内镜治疗脑积水的报道。之后是神经内镜辅助垂体腺瘤手术的报道,慢慢过渡到单纯神经内镜技术完成垂体腺瘤手术的报道。
二、手术适应证和禁忌证
神经外科领域适用内镜经鼻手术进行各类垂体腺瘤的切除术。垂体微腺瘤、垂体大腺瘤,尤其是侵袭性不规则生长之垂体腺瘤,均可使用内镜扩大经鼻蝶窦入路手术进行治疗。鞍内鞍上起源的其他类型肿瘤,如:Rathke囊肿、部分颅咽管瘤、脑膜瘤、生殖细胞瘤、脊索瘤、胆脂瘤、软骨肉瘤、转移瘤、垂体脓肿等,均可采用内镜经鼻手术。
对于复发的需再次手术的患者,内镜经鼻入路手术可发挥其显露好的优势,并可清晰地显露粘连、瘢痕,完整地显露蝶窦,有助于提高复发肿瘤的手术疗效。
手术禁忌证:①鞍上向前方向侧方侵袭的特别巨大的肿瘤,不推荐内镜经鼻手术;②血运丰富和肿瘤质地坚韧者,不推荐内镜下手术;③鼻窦脓肿等。
三、手术设备和器械
全面的神经内镜一体化手术室是完成各类神经内镜下手术的必要条件,配置这些辅助设备,一方面是为了确保手术能够顺利实施,另一方面就是一旦出现意外,可以及时妥善的处理,避免进一步对患者造成伤害。其主要设施应包括:神经内镜系统(包括内镜固定架和术中冲洗泵)、高速磨钻(气动或电动)、神经导航系统、术中超声或多普勒监测以及术中磁共振等辅助设施。
高品质设计的手术器械,具有简单、方便、精准和易操控性,为术者完成高质量的手术提供保障。内镜下器械有其特殊要求,由于空间狭小,其形状和大小均会影响操作。配合内镜技术所采用的器械,如果使用“刺刀型”,会遮挡或干扰内镜,所以器械一般采用“枪式”设计,工作长度在15~18cm为宜。剥离器、刮匙、组织咬钳等器械应选择“枪式”或末端成角的内镜器械。
四、术前评估和术前准备
对于垂体腺瘤的手术治疗需要制定个体化的手术方案。术前需要详细了解患者和家属的主要诉求是什么,患者的症状体征,全身其他系统功能状况、内分泌激素检查结果、肿瘤的影像学特征等;综合评估一下目前患者的状态,适不适合手术治疗,是否需要手术治疗,手术能达到什么样的效果,手术风险怎样,以及如果不做手术会怎样。对患者病情准确评估并预测各种治疗方案后,充分与患者和家属沟通,取得患者理解和信任后再确定是否手术。
由于复发肿瘤(包括术后残留)者再次手术疗效明显下降,且手术风险明显增高,需要进一步评估。之前的手术治疗可致鞍区解剖结构紊乱,原手术路径和术区瘢痕形成,肿瘤及瘢痕与重要的神经血管粘连,肿瘤组织和残留垂体的界面有时难以分辨清楚,尤其是前次术中应用“化学胶”者,术中情况更复杂,导致再次手术的难度和风险明显高于初次手术,脑脊液漏和颈内动脉损伤的风险也明显增加。明确再次手术指征之后,必须综合评估患者全身情况,做好全面的术前准备工作,并考虑如下一些可能会影响再次手术效果的因素:①之前的手术者是谁?手术经验是否丰富?医院的条件设备如何?是肿瘤残留还是肿瘤再次生长?除非有足够证据证明患者可以通过此次手术获益,否则轻易不要再次手术;②详细了解既往手术前后的病情变化,包括症状体征、影像学和激素水平,评价治疗效果,分析肿瘤复发因素;③充分了解过往手术情况(可以借助手术记录),根据手术重要信息,判断再次手术的难度,做好术前计划。这些重要信息包括:手术是否顺利、有无静脉窦或动脉出血等影响手术进程的因素、有无术中脑脊液漏及具体修补方法和材料等;④术后恢复情况,包括术后神经血管和垂体及下丘脑功能;⑤术后病理学结果,尤其是Ki67增殖指数和2017年垂体腺瘤新分类中的亚型结果。对提示存在高复发风险的肿瘤,应制定详细的术后辅助治疗方案;⑥充分与患者和家属沟通,强调复发肿瘤再次手术的必要性和风险,尤其是有多次手术、药物治疗和放疗史,且肿瘤呈侵袭性生长的患者;⑦术者应对手术硬件设施条件和自身手术经验做出客观的评估,确定是否具备完成再次手术的条件(比如:显微镜、神经内镜、神经导航、动力系统、血管多普勒超声和神经电生理监测等),以及围手术期处理各种并发症的能力;⑧术前常规行多学科团队(MDT)联合会诊,充分讨论手术的可行性,制定最佳治疗方案。制定详细周密的手术计划是再次手术成功的关键。根据既往手术情况、肿瘤影像学特征和术者经验等综合因素,决定经蝶窦入路还是经颅入路。一般来说,经蝶窦入路仍然是复发性肿瘤的首选入路,经颅入路则适用于切除广泛累及前颅底、鞍旁和三脑室等处的巨大垂体腺瘤。侵袭性垂体腺瘤常向鞍外、鞍旁生长,传统显微镜经蝶窦入路显露肿瘤非常有限。
再次评估术者和手术团队的能力、经验和水平,评估手术设备和条件是否完备。综合各方面情况,制定个体化的手术预案,并且再次与患者和家属沟通,交代各项事宜。
对于一些特殊类型的垂体腺瘤患者,如侵袭性垂体生长激素腺瘤伴严重的咽腔狭窄、呼吸睡眠暂停、低氧血症、心力衰竭,不能耐受手术者,首选生长抑素类似物药物治疗,待一般情况改善后,再行手术治疗。对于垂体促甲状腺激素腺瘤导致的中枢性甲亢,抗甲状腺药物治疗效果不佳时可给予长效生长抑素类似物治疗,降低术中及术后发生甲状腺功能危象的风险。对于咽腔重度狭窄的垂体生长激素腺瘤患者,如果插管困难,可以喉罩通气或可视喉镜直视下插管,也可以在局麻下行气管切开,插管接呼吸机。
五、手术过程
患者体位与显微镜相似,但略有不同,头部位置可以更高一些。主要是一方面要满足术区位置高于心脏水平,便于静脉回流;同时术者术中操作方便。术中应配置神经导航来了解术中各解剖结构。
手术主要由两位医生共同完成,可以是两位神经外科医生,也可以是一位神经外科医生和一位耳鼻喉科医生。无论哪种组合都需要双方互相了解,各有所长,共同应对手术当中可能出现的各种情况。根据习惯,两位术者可以分列患者两侧,也可在同一侧,监视器位于患者头侧,术者可通过显示器观察术区。这里特殊强调一下,就是内镜下完成手术时,只能观察到内镜镜头前方的视野,无法像手术显微镜那样可以观察到整个术区。手术方式有单人双手或双人三手单鼻孔入路以及双人三手或四手双鼻孔入路。后者运用三手或四手技术切除垂体腺瘤的关键是可以最大程度地四手配合进行术中操作。
患者麻醉后,摆置体位并固定。摆放各种设备,导航系统注册,术区消毒铺巾。再次核对导航位置是否准确,鼻腔消毒,副肾盐水棉片填塞鼻腔收缩鼻腔黏膜,明确鼻腔内各解剖位置后开始手术。U型切开鼻中隔黏膜,游离并拉向后鼻孔处。有时为了更多的保护鼻黏膜,也有直接找到蝶窦开口,局部切开少许黏膜后进入蝶窦腔。明确定位后,沿蝶窦开口,高速磨钻或Kerrison咬骨钳扩大蝶窦骨窗。清除蝶窦内横膈纵隔及蝶窦黏膜后,再次明确鞍底、鞍结节、颈动脉隆起、颈动脉视神经隐窝等解剖结构,确保手术入路准确(图1)。
内镜下明确鞍底位置及斜坡、鞍结节、双侧海绵窦、颈内动脉隆起、颈动脉视神经隐窝、视神经管入口等解剖位置无误后,根据肿瘤位置、性质和大小,按照术前计划,用高速磨钻和Kerrison咬骨钳结合打开鞍底。显微镜下切除肿瘤过程详见下图(图2)。
肿瘤切除满意后,仔细止血,观察鞍膈处是否有脑脊液漏或渗出。如果没有脑脊液漏,常规重建鞍底,鼻中隔黏膜复位,鼻腔填塞压迫止血,手术结束。如果鞍膈破裂或出现明显脑脊液漏时,采用阔筋膜脂肪“三明治填塞法”重建鞍底,鼻腔黏膜瓣贴附后,蝶窦内叠瓦状致密填塞碘仿纱条压迫(术后3~4周取出),手术结束(图3)。
內镜下扩大经鼻蝶窦入路还用于其他颅底中线区域的各种肿瘤,包括鼻窦恶性肿瘤和嗅沟脑膜瘤、经蝶骨平台鞍结节切除鞍上颅咽管瘤和鞍结节脑膜瘤、经斜坡处理斜坡脊索瘤和软骨肉瘤等。
六、术中手术技巧
再次强调术者应该接受系统的颅底解剖培训和内镜操作训练。复杂病例术中行神经导航、多普勒超声监测,必要时术前行CTA或DSA检查,了解肿瘤和血管之间的关系和侧支循环代偿情况。内镜下经鼻手术的开展有一学习曲线,只有在熟练常规内镜经鼻手术技术后才可以开始开展手术,并在处理复杂病例和开展扩大经鼻蝶颅底入路手术时得心应手。
术中鼻中隔黏膜的完整游离是减少出血、保持整个手术中术野清洁的关键。接下来要广泛的显露蝶鞍区、鞍底骨窗范围应足够大,硬膜切口向上及两侧延伸时要小心避免切开海绵间窦及海绵窦。开始切除肿瘤时,应辨认肿瘤假包膜是否完整,尽可能沿肿瘤假包膜外分离并切除肿瘤。侵袭性肿瘤切除过程中要避免损伤神经及动脉,术中对海绵窦内肿瘤的切除应该在内镜直视下进行,不能盲目刮除或牵拉肿瘤。术中应随时判断并发症发生的可能性,在切除肿瘤和是否引发并发症之间进行权衡。优秀的神经外科大夫,不仅仅是知道如何切除肿瘤,更重要的是要知道什么时候有风险,及时终止手术。如果术中出现脑脊液漏,在切除肿瘤并止血后,应依据术中的脑脊液漏程度进行鞍底重建。如漏口较小可以使用人工硬膜等材料进行修补,脑脊液漏明显时应考虑行多层颅底重建。目前国内外多采用自体脂肪及筋膜加上带蒂鼻中隔黏膜瓣进行颅底重建。
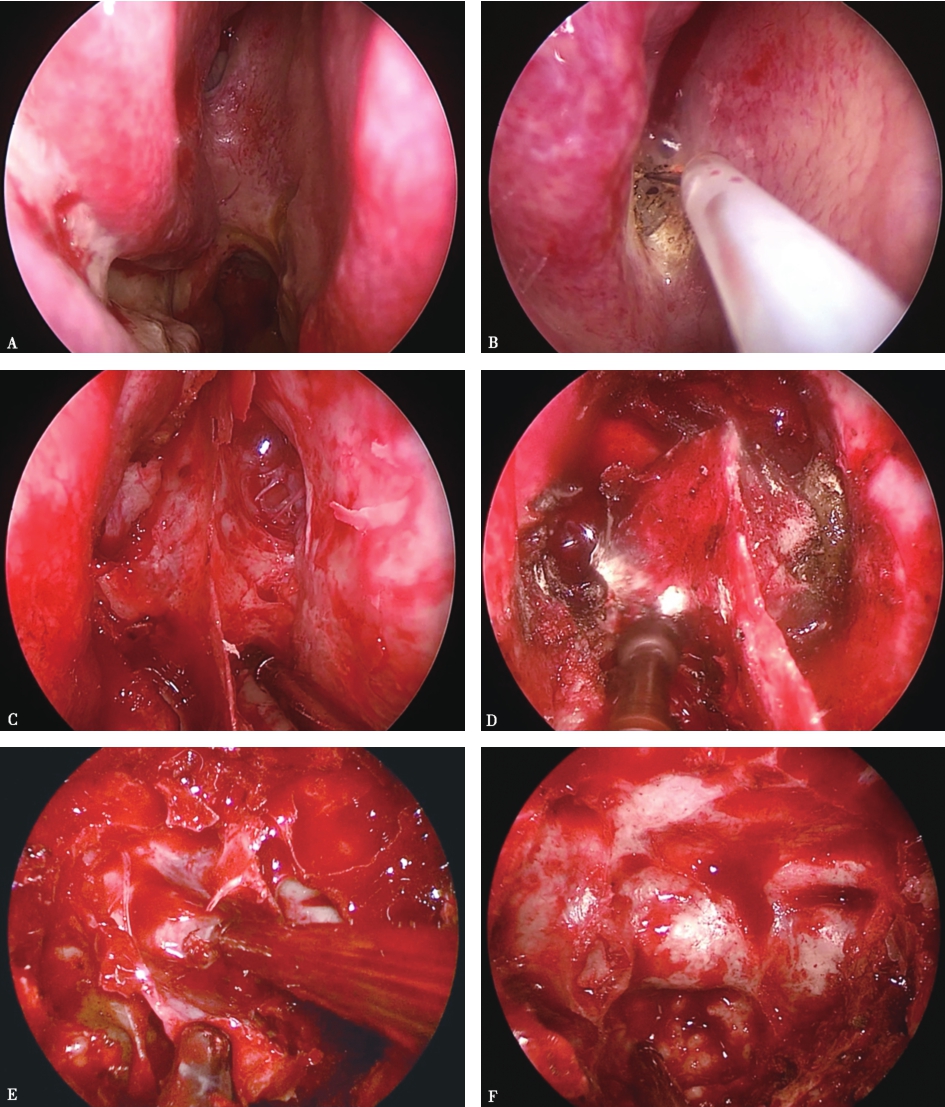
图1手术过程
A.内镜下显露右侧鼻腔,通过定位后鼻孔上方的鼻中隔与中鼻甲之间蝶筛隐窝来确定蝶窦开口的位置;B.用电刀从蝶窦开口开始切开鼻黏膜,行鼻中隔黏膜瓣成型,黏膜瓣的蒂部留在中上鼻甲根部内侧的蝶筛隐窝处,此处有蝶腭动脉的分支鼻后中隔支,供应整个鼻中隔黏膜的血供,即可供应带蒂的鼻中隔黏膜瓣,作为颅底重建的血运来源;C.黏膜瓣制备后,去除骨性鼻中隔的根部,显露整个蝶窦前壁,向上显露到蝶窦开口以上,向下显露蝶窦喙部;D.用高速磨钻将蝶窦前壁磨除;E.进入蝶窦腔后,可见蝶窦腔内有数量不等、不规则的骨性分隔,分隔及蝶窦表面均有黏膜覆盖,去除黏膜和骨性分隔,清晰显露蝶窦后壁的结构;F.在蝶窦后壁上,可以观察到的结构有鞍底、斜坡、双侧颈内动脉隆起、海绵窦隆起、视神经管隆起、视神经管-颈内动脉隐窝、鞍结节等。显露更多的正常结构有助于判断鞍底的位置,因为若蝶窦气化不良或者蝶窦气化太好,均有可能导致定位失误。蝶窦气化不好可能会导致无法判断鞍底位置,蝶窦气化太好,有可能将颈内动脉隆起、视神经管隆起误认为是鞍底,导致手术并发症。可借助于C型臂、导航来定位,增加手术的安全性。
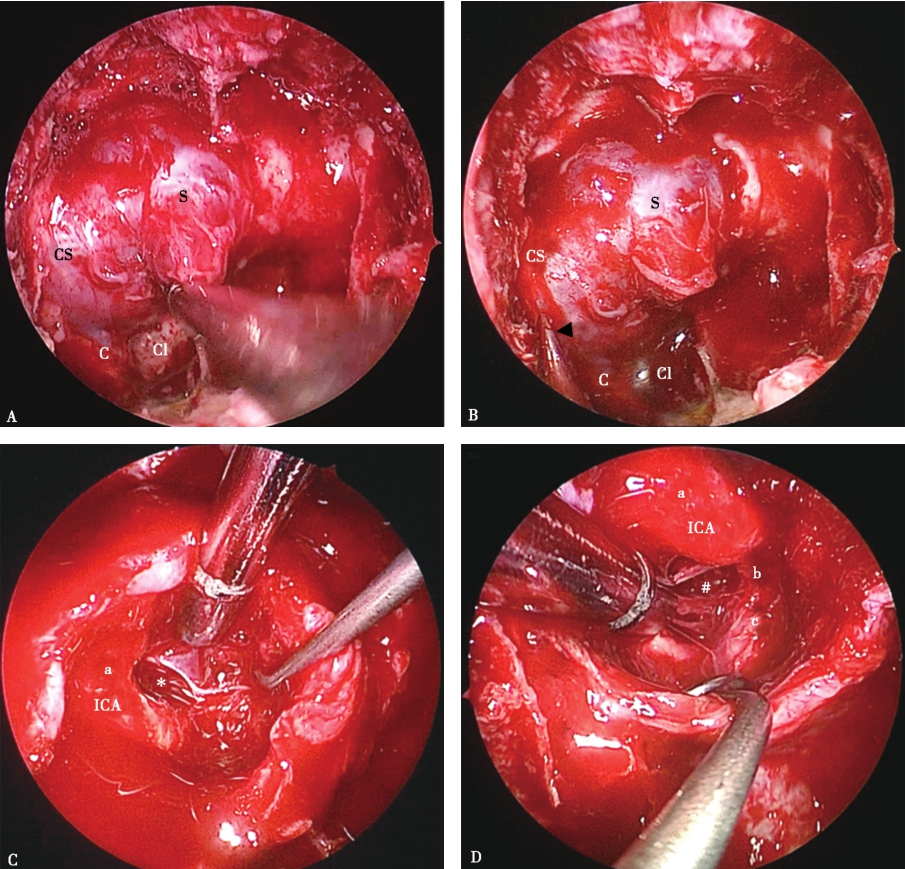
图2神经内镜下切除侵袭右侧海绵窦的垂体腺瘤
A.高速磨钻磨开鞍底骨质,显露鞍底及右侧海绵窦腹侧壁的硬膜,显露范围根据肿瘤大小和生长方向而定;B.多普勒超声探头探测右侧海绵窦内颈内动脉的位置(箭头);C.内镜下切开鞍底硬膜,切除鞍内肿瘤后显示右侧海绵窦内侧壁缺损(*);D.神经内镜下进一步显露并切除右侧海绵窦内颈内动脉外侧肿瘤(#),颈内动脉完全游离,充分反映神经内镜下显露充分的优势。a.前曲;b.水平段;c.后曲;C.颈内动脉隆起;Cl.斜坡;CS.海绵窦;ICA.颈内动脉;S.鞍底
七、术后处理
同手术显微镜下手术。术后常规给予激素(垂体ACTH腺瘤除外),抗生素及止血药物治疗。如果术后出现意识障碍以及视力障碍进行性加重,要考虑瘤腔出血的可能,鞍膈缺损明显以及扩大经蝶窦入路手术时还会出现蛛网膜下腔出血甚至脑室内出血铸型,头颅CT证实后需要急诊手术清除血肿或行脑室穿刺外引流术。术后如果出现单纯的第Ⅲ、Ⅳ和Ⅵ脑神经麻痹,采取药物治疗,大多数患者6个月内可以恢复。术后因下丘脑损伤导致的意识障碍及下丘脑功能异常,只需对症处理、治疗即可。很多患者术后会出现一过性尿崩及电解质紊乱,对症处理。对于术中有明显脑脊液漏或直接打开鞍膈在鞍上切除肿瘤的患者,根据需要术后去枕平卧1~2天。一般情况下无需术后(术前)留置腰蛛网膜下腔引流管持续引流脑脊液。仍反复出现脑脊液漏患者,需要再次手术修补。
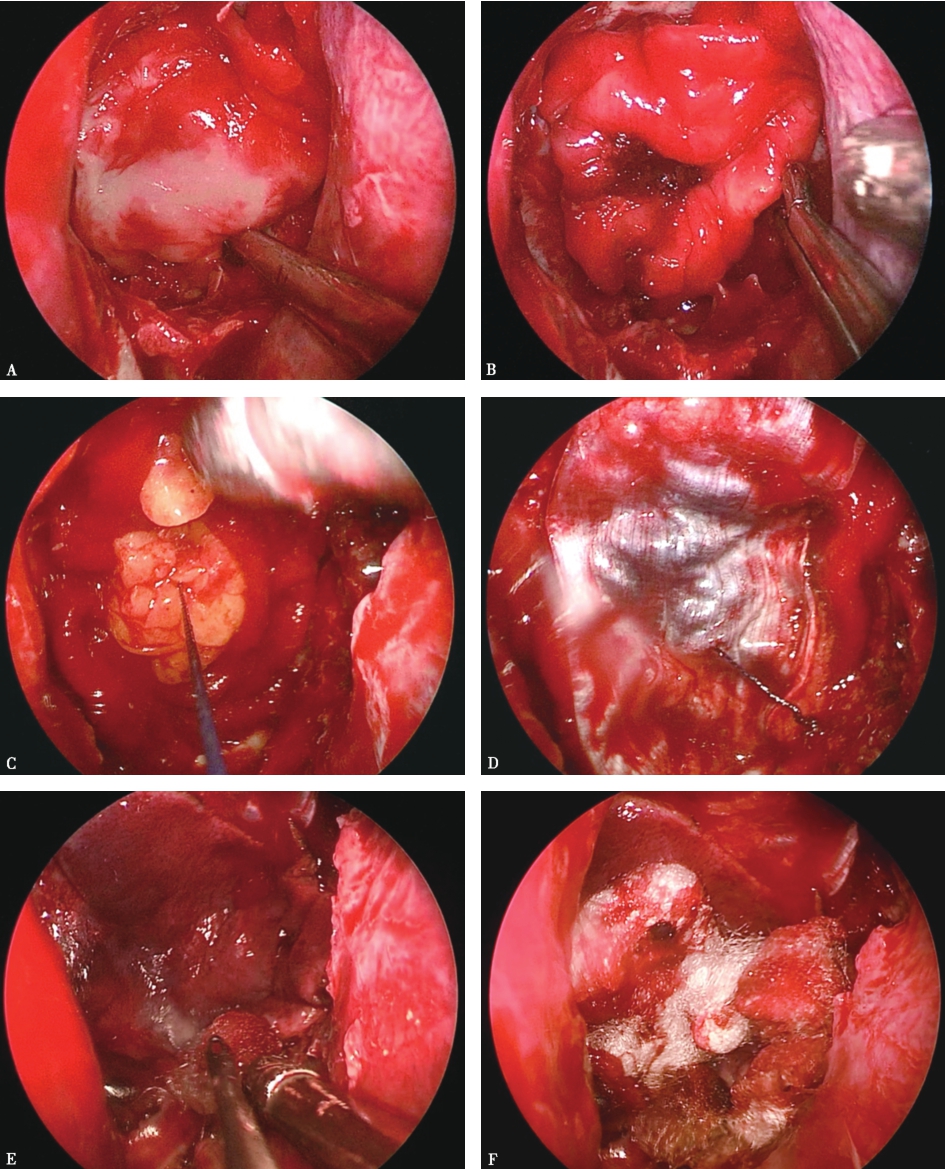
图3手术结束
A.先用人工硬膜覆盖鞍膈;B.然后选用可吸收止血材料填充鞍内,鞍内的填充可以起到压迫止血的作用,但鞍内填充一定要适量,若过度填充,则可能对视交叉、双侧海绵窦造成压迫,导致视交叉及海绵窦神经受损伤;C.若患者为明显脑脊液漏,鞍内填充可选用自体脂肪组织;D.再用足够大小的自体筋膜覆盖鞍底。自体脂肪的优势在于,在一定时间内起到支撑、填充的作用,不产生排斥反应,可起到隔绝脑脊液的作用,为鞍底愈合创造条件及时间;E.在蝶窦腔,先用带蒂的鼻中隔黏膜瓣覆盖整个蝶窦后壁,黏膜瓣在手术早期取材时就必须考虑到长度及宽度,若黏膜瓣大小不够,则可和自体筋膜相互配合,务必将手术开放的蝶窦后壁完整覆盖;F.蝶窦填塞主要起到支撑颅底重建的复合材料的作用,如果没有脑脊液漏,可用可吸收的材料进行蝶窦填塞,如:可吸收凝胶海绵等。如果是明显脑脊液漏的病例,可采用碘仿纱条或尿管水囊对重建材料进行支撑,待颅底愈合后再将支撑材料撤走
出院前进行全面的内分泌学评估,复查鞍区MRI,根据患者具体情况向患者及家属交代出院后注意事项,制订随诊计划。对于术中曾有脑脊液漏的患者,术后3个月内避免提重物、咳嗽和便秘。
值得注意的是,内镜技术完成手术的患者,术后嗅觉下降甚至消失的患者比例明显增加,同时蝶窦炎症或鼻部不适的患者比例也增加,需要引起注意。预防办法就是尽量减少对鼻黏膜的损伤和破坏,蝶窦内尽可能减少人工修补和止血材料的填充。此外,手术后一周左右可行内镜下鼻腔及鼻窦检查及冲洗,清除结痂、血块、分泌物、止血材料及组织分解材料。
教授,博士研究生导师。曾任神经外科主任,中华神经外科学会常委兼秘书长,多项国家和省市基金项目评委。担任《中华医学杂志》《中华神经外科杂志》《现代神经疾病》《国外医学脑血管病分册》《Brain Research》等国内外多家医学专业杂志编委和论文评阅人。
医学博士。擅长下丘脑垂体疾病的诊治,鞍区肿瘤、颅底及交界区肿瘤、颅后窝肿瘤的诊治。擅长神经内镜等微创手术,每年完成500例手术,至今已完成超过4000例鞍区肿瘤的手术、神经内镜手术逾2500例。
教授,博士研究生导师。北京协和医院垂体疾病创新诊疗中心主任,中国垂体腺瘤协作组副组长兼秘书长,中华医学会行为医学分会儿童下丘脑垂体疾病学组组长,中国罕见病联盟下丘脑垂体疾病学组秘书长,主要负责并组织编写多部各亚型垂体腺瘤诊治规范及专家共识。承担国家自然基金及国家十二五重点课题等多项课题。
男,博士研究生导师。北京协和医院神经外科副主任,国家重点研发计划“干细胞及转化研究”重点专项首席科学家。擅长垂体腺瘤、脑膜瘤、听神经瘤、面肌痉挛、三叉神经痛的治疗。
免责声明
内容来源于人卫知识数字服务体系、人卫inside知识库,其观点不反映优医迈或默沙东观点。 此服务由优医迈与胤迈医药科技(上海)有限公司授权共同提供。
如需转载,请前往用户反馈页面提交说明:https://www.uemeds.cn/personal/feedback
人卫知识数字服务体系






 Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
