55岁女性,因“左下腹反复疼痛2月余,加重1个月”就诊,腹部CT可见肾脏及盆腔两处新生物,如何诊治?
【病例摘要】
患者,女性,55岁,因“左下腹反复疼痛2月余,加重1个月”就诊于四川大学华西医院。查体:下腹部触及8cm×7cm包块,质韧,活动性差。
既往史及家族史
无特殊,家族中无类似病史。
体格检查
生命体征平稳,一般情况可。腹部体检:全腹软,下腹部可扪及直径8cm×7cm包块,质韧,活动度差。直肠指诊:(-)。
辅助检查
血常规:血红蛋白72g/L↓。
血生化:谷丙转氨酶38U/L,谷草转氨酶36U/L,白蛋白27.1g/L↓,肌酐58.8µmol/L。
肿瘤标志物:CEA、CA199、CA125未见异常。
全腹增强CT:①盆腔积液、积血,盆腔软组织密度肿块影,最大截面约15cm×9cm,与子宫分界不清,增强扫描呈明显不均匀强化,内见血管影(图1);②左肾中上份见巨大不规则占位,最大截面约15cm×10cm,内散在点状钙化灶,增强扫描呈明显不均匀强化,左右肾受压下移(图2)。
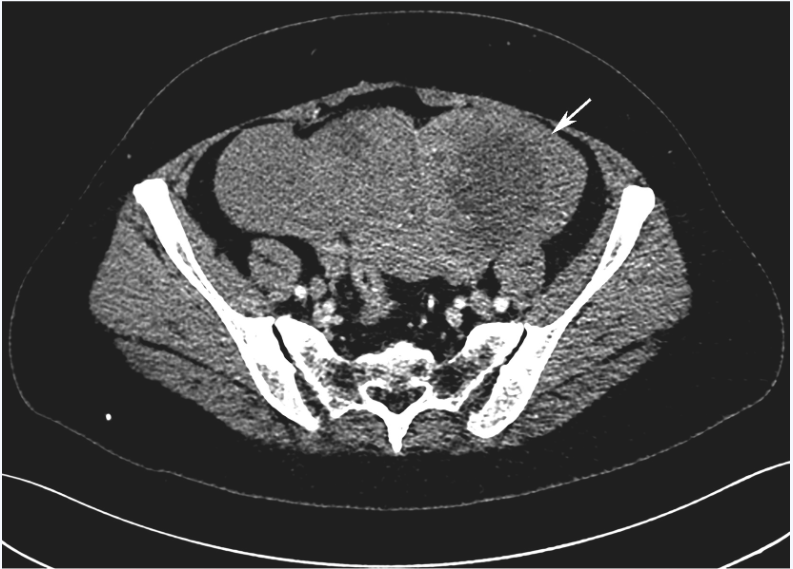
图1 增强CT示盆腔巨大占位
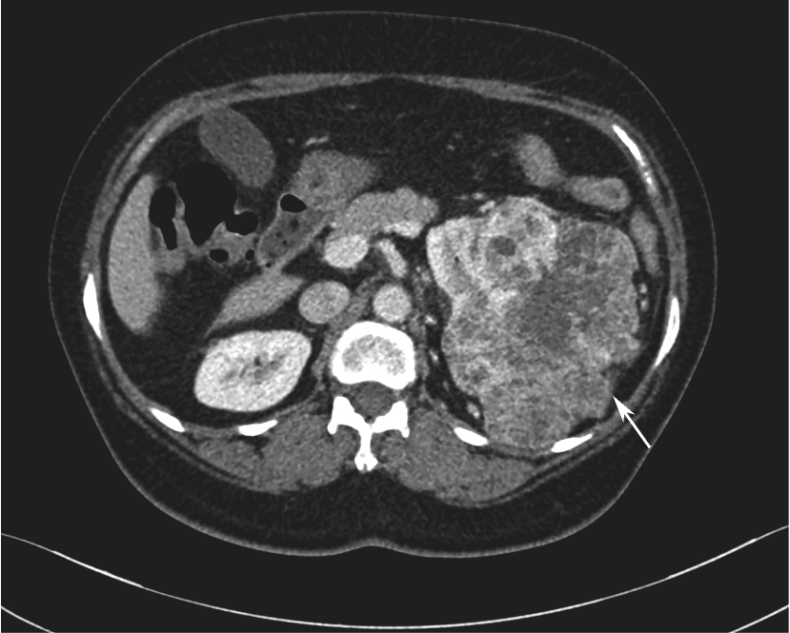
图2 增强CT示左肾占位病变
初步诊断
1.腹腔巨大新生物性质待查
2.左肾巨大占位性质待查
3.中度贫血
【治疗过程】
(一)病例分析
患者腹部CT可见肾脏及盆腔两处新生物,根据影像学表现,肾脏肿物考虑左肾癌,盆腔肿物考虑小肠来源的肿瘤,GIST或淋巴瘤?转移性肿瘤也不能除外,其中盆腔包块与邻近组织关系密切,且伴有出血,手术不一定能完整切除,风险较大,首先应明确病变性质,因GIST肾脏转移或肾癌盆腔转移罕见,不排除多原发肿瘤可能,建议对两处病灶分别进行穿刺活检。于CT引导下行肾脏穿刺及腹腔包块穿刺,穿刺病理示:①左肾囊性肾细胞癌;②(腹腔)GIST:小肠来源?免疫组织化学染色:CD117(+),DOG-1(+),CD34(-),S-100(-),Ki-67(Li:约5%~8%)。基因检查提示c-KIT 11外显子(E554-K558 del)缺失突变。
患者明确为肾细胞癌合并盆腔GIST,全身影像学检查未见其他部位转移。分别对两处病灶进行评估,肾脏肿瘤为可切除病灶,泌尿外科建议手术切除;盆腔GIST累及肠管范围较大,且与邻近组织分界不清,血供丰富。此时如同期进行左肾肿瘤切除及盆腔GIST切除,会增加GIST肿瘤破裂种植风险或合并脏器切除可能性大。经MDT讨论,建议安排泌尿外科择期手术,并行术前准备。与此同时患者开始伊马替尼400mg/d治疗。
(二)治疗方案
患者开始400mg/d伊马替尼治疗2周后,复查腹部CT见:①左肾中上份见巨大不规则肿块影,最大截面约15cm×10cm,其内密度不均匀,内散在点状钙化灶,增强扫描呈明显不均匀强化,可见粗大引流静脉,肾盂受压积液。肿瘤体积与前无明显变化。②盆腔偏右份见不规则肿块影,最大截面约9cm×9cm,增强扫描呈明显不均匀强化,盆腔肿块较前明显缩小(图3)。再次MDT讨论决定行同期肾脏肿瘤及盆腔肿瘤切除。
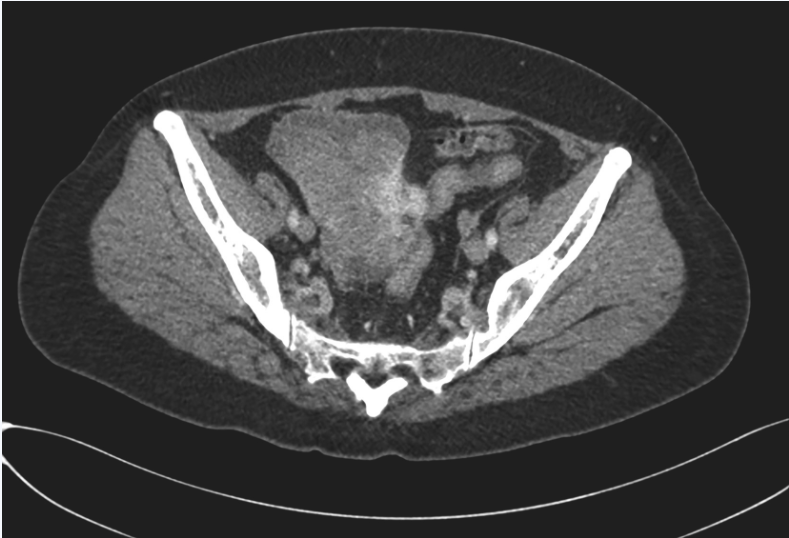
图3 术前治疗后复查CT示盆腔GIST明显缩小
患者于全麻下行“小肠包块切除肠吻合术+左肾肿瘤根治性切除+腹膜结节切除术”。术中所见:腹腔内少许血性渗液,小肠距屈氏韧带130cm处系膜侧可见一大小约8cm×6cm包块,坠入盆腔,包块与盆底腹膜粘连,膀胱及子宫表面可见两个直径约1.5cm结节。左侧肾脏可扪及一15cm×10cm包块,与周围组织分界清楚,上极达到脾脏后方,后方与腰大肌轻度粘连。手术过程顺利。
(三)术后病理及基因检测
术后病理:1.(小肠)胃肠间质瘤,靶向治疗后。核分裂象:1个/50HPF,肿瘤内可见坏死。
免疫组织化学染色:CD117(+)、DOG-1(+)、CD34(+)、SMA(+)、SDHB(+)、Desmin(-)、S-100(-)、Ki-67(Li:1%)。
【预后】
术后患者恢复良好出院,口服伊马替尼靶向治疗。规律随访15个月患者无病生存。
【经验与体会】
目前对伴发其他肿瘤的GIST患者预后情况的研究并不多,华中科技大学同济医学院附属协和医院对行同期手术切除的同时伴发其他恶性肿瘤的七十余例GIST患者进行生存分析,发现伴发其他恶性肿瘤的GIST患者的预后显著劣于不伴其他肿瘤的GIST患者,同其他同类研究结果一致。
尽管随着对c-KIT与PDGFRA基因在GIST致病机制中的了解加深,GIST大部分的生物学特点已被研究者及临床工作者认识,但总体而言GIST仍是一类异质性相对较高的肿瘤。2018年的一篇纳入405例患者的研究提出,GIST同肾细胞癌可能存在潜在的联系:GIST同肾细胞癌的患者均可使用靶向药物舒尼替尼改善生存。复旦大学附属中山医院曾报道一例SDHA胚系突变导致野生型GIST和肾细胞癌同时伴发的罕见病例,提示此类患者中可能存在共同的致病机制,但并不见于大多数病例。
患者同时存在肾癌和GIST,两种病灶来源不同,但都需要及时干预,在制订治疗方案时需要谨慎。目前,伊马替尼术前治疗是临床常见的GIST治疗方案,得到几乎所有GIST治疗指南的推荐。根据《中国胃肠间质瘤诊断治疗共识(2017年版)》的意见,术前治疗的推荐时间为达到最大缓解,即两次复查肿瘤体积稳定,一般为6~12个月。根据已有的证据,对于伊马替尼敏感的GIST病灶在开始药物治疗后短短1周的时间内,就已经可以通过影像学检查观察到疗效,根据四川大学华西医院术前治疗的回顾性资料,大多数患者在药物治疗3个月左右即达到最大疗效。需要注意的是,GIST术前治疗与胃癌、肠癌新辅助治疗不同,并无证据表明术前治疗能够整体改善患者预后,其目的在于减少手术风险,避免联合脏器切除,保留器官功能。因此,达到最大肿瘤缩小程度,或大于6个月的术前治疗时间并不应该作为术前治疗追求的目标。在肾脏肿瘤和盆腔巨大GIST共存的情况下,如同期手术,则GIST破裂种植风险较大;如针对GIST进行常规伊马替尼足疗程术前治疗,待肿瘤体积达最大疗效后手术,则可能导致肾脏肿瘤进展,或需要分期手术。本病例中患者接受短时间的伊马替尼治疗,肿瘤迅速缩小,遂行同期手术。该病例提示我们,在GIST诊治过程中,可以根据患者具体情况,制订个体化的治疗策略,安排药物治疗和手术时机,争取最大获益。
舒尼替尼在肾癌与GIST中均作为指南推荐的药物。尽管在GIST与肾细胞癌中舒尼替尼起效所作用的靶点有所不同,但是舒尼替尼在同时伴发此两类肿瘤的患者中也有一定的应用价值。四川大学华西医院泌尿外科的一篇病例报道中,患者同时伴发胃GIST与肾透明细胞癌,初诊时即发现肝门静脉有转移灶。在手术切除两处原发肿瘤后,患者口服舒尼替尼治疗,门静脉转移灶完全消失。伴发肾癌的GIST患者如果出现GIST疾病进展,应根据情况考虑使用伊马替尼或舒尼替尼进行靶向治疗。
(撰稿人:张兰 张睿智 尹晓南)
【专家点评】
李勇
教授,主任医师,博士研究生导师
河北医科大学第四医院外三科主任、外科教研室副主任
中国抗癌协会胃肠间质瘤专业委员会主任委员
中国临床肿瘤学会胃肠间质瘤专家委员会常务委员
中国医师协会外科医师分会肿瘤外科医师委员会常务委员
中国抗癌协会胃癌专业委员会委员
GIST伴发泌尿生殖系肿瘤中最常见的是前列腺癌,GIST伴发肾癌较少见。患者体内同时存在两种恶性肿瘤,尤其是两种肿瘤均发展至较重的程度,给临床治疗带来了较大的困难。不同于伴发消化道癌的GIST,原发肿瘤与伴发肿瘤起自邻近的组织来源,肾癌与GIST不仅来自于不同的组织,潜在的致癌因素也差距较大,两者同时起病的原因可能与共同的致病基因相关。对于这样的患者,术前应有完整的病理诊断,组织MDT讨论以制订合理的治疗方案为宜。术后再次行MDT讨论,依据完整的病理资料(肿瘤性质、危险度、分期、基因检测结果)综合分析,制订合理的术后辅助治疗方案。
苹果酸舒尼替尼已明确可用于治疗晚期GIST和肾癌;目前尚未明确用于肾癌术前治疗或术后辅助治疗,值得在这方面探索,可能使此类患者获益。本例患者GIST病灶较大,直接手术有困难,行术前治疗是比较好的选择,多靶点靶向药物舒尼替尼可同时用于两个肿瘤的治疗,也提示我们两者的发病机制可能存在共通之处,如果术前治疗应用舒尼替尼,当两个肿瘤均需术后辅助治疗,术后再用舒尼替尼辅助治疗,预计可使患者受益,可能也是一个不错的选择。《中国胃肠间质瘤诊断治疗共识(2017年版)》推荐患者术前伊马替尼靶向治疗的时限控制在6~12个月避免继发耐药,而在瘤体较大的伴发其他恶性肿瘤的GIST患者中,不仅应该监测GIST对靶向药物的治疗反应,也应同时注意监测伴发肿瘤的情况,以免任一肿瘤疾病进展错过最佳手术时机。有研究报道,部分患者行伊马替尼术前治疗2周便有明显疗效,本例患者就是如此,不过2周的术前治疗时间是否足够还需探讨。
【参考文献】
[1] MENDONCA S J, SANCHEZ A, BLUM K A, et al. The association of renal cell carcinoma with gastrointestinal stromal tumors [J] . J Surg Oncol, 2018, 117 (8) : 1716-1720.
[2] MOTZER R J, ESCUDIER B, GANNON A, et al. Sunitinib: Ten Years of Successful Clinical Use and Study in Advanced Renal Cell Carcinoma [J] . Oncologist, 2017, 22 (1) : 41-52.
[3] MURPHY J D, MA G L, BAUMGARTNER J M, et al. Increased risk of additional cancers among patients with gastrointestinal stromal tumors: A population-based study [J] .Cancer, 2015, 121 (17) : 2960-2967.
[4] KRAMER K, WOLF S, MAYER B, et al.Frequence, spectrum and prognostic impact of additional malignancies in patients with gastrointestinal stromal tumors [J] . Neoplasia, 2015, 17 (1) : 134-140.
[5] GILL A J, LIPTON L, TAYLOR J, et al. Germline SDHC mutation presenting as recurrent SDH def i cient GIST and renal carcinoma [J] . Pathology, 2013, 45 (7) : 689-691.
[6] PANDURENGAN R K, DUMONT A G, ARAUJO D M, et al. Survival of patients with multiple primary malignancies: a study of 783 patients with gastrointestinal stromal tumor [J] .Ann Oncol, 2010, 21 (10) : 2107-2111.
[7] AGAIMY A, WÜNSCH P H, SOBIN L H, et al. Occurrence of other malignancies in patients with gastrointestinal stromal tumors [J] . Semin Diagn Pathol, 2006, 23 (2) : 120-129.
[8] LI J, YE Y, WANG J, et al. Chinese consensus guidelines for diagnosis and management of gastrointestinal stromal tumor [J] . Chin J Cancer Res, 2017, 29 (4) : 281-293.
[9] TAO J, NI C, JIN Y, et al. The coexistence of clear cell renal cell carcinoma and gastrointestinal stromal tumor with portal vein metastasis, and its favorable response to sunitinib [J] .Expert Rev Anticancer Ther, 2013, 13 (2) : 131-136.
[10] CONNOLLY E M, GAFFNEY E, REYNOLDS J V. Gastrointestinal stromal tumors [J] . Br J Surg, 2003, 90 (10) : 1178-1186.
[11] VASSOS N, AGAIMY A, HOHENBERGER W, et al. Coexist ence of gastrointestinal stromal tumours (GIST) and malignant neoplasms of different origin: prognostic implications [J] .Int J Surg, 2014, 12 (5) : 371-377.
[12] JIANG Q, ZHANG Y, ZHOU Y H, et al. A novel germline mutation in SDHA identified in a rare case of gastrointestinal stromal tumor complicated with renal cell carcinoma [J] .Int J Clin Exp Pathol, 2015, 8 (10) : 12188-12197.
[13] 曹晖, 高志冬, 何裕隆, 等. 胃肠间质瘤规范化外科治疗中国专家共识 (2018版) [J] . 中国实用外科杂志, 2018, 38 (9) : 965-973.
[14] TANG S, YIN Y, SHEN C, et al. Preoperative imatinib mesylate (IM) for huge gastrointestinal stromal tumors (GIST) [J] . World J Surg Oncol, 2017, 15 (1) : 79-86.
(环球医学编辑:常路)
免责声明
版权所有©人民卫生出版社有限公司。 本内容由人民卫生出版社审定并提供,其观点并不反映优医迈或默沙东观点,此服务由优医迈与环球医学资讯授权共同提供。
如需转载,请前往用户反馈页面提交说明:https://www.uemeds.cn/personal/feedback
来源:《胃肠间质瘤典型病例诊治与解析》
作者:陶凯雄 曹晖
页码:190-194
出版:人民卫生出版社





 Copyright © 2023 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
Copyright © 2023 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
