筛查早诊是提高肝癌五年生存率的最有效的关键措施。肝癌筛查目的是提升早期肝癌发现率,从而提高肝癌五年生存率。我国肝癌主要由慢性乙型肝炎、肝硬化等慢性肝病发展而来,肝癌筛查早诊分三个环节,即慢性肝病筛查、肝癌高危人群分层及肝癌监测随访。除传统B超和血清甲胎蛋白肝癌监测外,影像学诊断技术发展及新的分子标志物研发应用,能检测出直径1cm的小肝癌,并能对亚临床肝癌进行预警。试点推行借助社区健康小屋增加慢性肝病筛查和肝癌监测内容,逐步增强社区慢性肝病管理和肝癌监测能力,需在社区筛查早诊试点基地探索慢性肝病管理和肝癌筛查早诊的医院社区一体化模式。
《“健康中国2030”规划纲要》提出,到2030年总体癌症5年生存率提高15%。近几十年来肝癌诊疗技术进步巨大,但我国肝癌患者5年生存率仍然仅为12.1%,其原因主要是我国肝癌发现时多为中晚期,住院肝癌患者中5年生存率较高的早期肝癌患者不足30%。近十年来晚期肝癌系统抗肿瘤药物开发及综合治疗方案的研究有较大进步,使得晚期肝癌患者中位生存期由不足1年延长到2年左右,但距达到5年生存尚有较大距离。因此,必须在肝癌筛查早诊上下功夫,唯有大幅度提高早期肝癌发现比例,才有可能实现2030年提高肝癌5年生存率翻倍的目标。由此,肝癌筛查早诊显得尤其急迫和重要。近年来国内专家推出多部肝癌筛查预防指南或共识,包括中华预防医学会肝胆胰疾病预防与控制专业委员会发布的《原发性肝癌的分层筛查与监测指南(2020版)》、中华医学会肝病学分会发布的《原发性肝癌二级预防共识(2021年版)》、全国多中心前瞻性肝癌极早期预警筛查项目专家组发布的《中国肝癌早筛策略专家共识》以及国家癌症中心组织撰写的《中国人群肝癌筛查指南(2022年,北京)》等,为我国肝癌防控提供了重要技术指导参考。肝癌筛查的技术方法和流程相对简单,基本形成专家共识;但肝癌筛查早诊如何融入医院和社区卫生服务机构常规化实施,仍然是个难题,处于模式探索阶段。部分专家正在通过项目试点形式探索肝癌筛查早诊的医院社区一体化医防融合模式。本文结合专家指南的学术理论与医院社区一体化实施模式探索实践,对肝癌筛查早诊方案、实施中的相关问题进行探讨。
一、肝癌筛查及目标人群
疾病筛查是通过有效、简便和经济的检查方法,将可能患病的人群与未患病的人群区别开来。筛查(screening)与监测(surveillance)不同,筛查是对某地区特定人群的疾病普查;监测是对某疾病高危人群的跟踪随访的疾病检查。相比筛查系统更为成熟的癌种,肝癌筛查的人群覆盖率仍相对较低,肝癌筛查对肝癌死亡率的下降效果相对较低或存在争议,肝癌预防需要普通人群筛查与高风险人群监测并重。由此,现阶段肝癌筛查策略应是在肝癌高危人群(而非普通人群)中监测发现早期肝癌患者(简称“早筛”),实现早诊早治,提高肝癌5年生存率。
我国肝癌高危人群有其显著特点。我国肝癌发生发展呈现典型的慢性肝炎、肝硬化、肝癌“三部曲”过程,肝癌高危人群主要是慢性肝病患者,包括慢性病毒性肝炎(慢性乙型肝炎和慢性丙型肝炎)、非酒精性脂肪性肝病/代谢相关脂肪性肝病、酒精性肝病、自身免疫性肝病等患者。我国慢性肝病以慢性乙型肝炎(chronic hepatitis B,CHB)与NAFLD,及其导致的肝硬化为主。我国86%肝癌患者伴HBV感染,77%肝硬化由HBV感染所致。因此,我国肝癌高危人群主要是CHB及乙肝相关性肝硬化患者。中华医学会肝病学分会和中华医学会感染病学分会制订的《慢性乙型肝炎防治指南》也日益将诊疗的硬终点指向肝癌。
我国慢性HBV感染者约8600万例,包括HBV携带者、CHB(约2000万~3000万)患者和肝硬化患者三类,其5年累积肝癌发病率依次为1%、3%和17%。慢性HBV 感染者肝癌发生的高危因素包括性别、年龄、HBV DNA高水平复制、HBV基因型(C>B)。HCC男女风险比约为3∶1;对比40岁以下人群,40~49岁人群风险增加3.6倍,50~59岁人群增加5.1倍,≥60岁人群增加8.3倍。因此,我国推荐肝癌高风险人群监测年龄为40~74岁。
我国丙型肝炎病毒(HCV)感染者约1000万,其HCC发病率与HCV相关肝纤维化程度相关,肝纤维化1~4期HCC年发病率依次为0.5%、2.0%、5.3%和7.9%。
我国MAFLD患病率为14.1%~29.6%,有日益增高趋势。MAFLD主要是非酒精性脂肪肝伴超重或肥胖、糖脂代谢紊乱。NAFLD相关HCC发病率为0.44/1000人年。MAFLD对中国人群HCC发病的确切风险度还有待进一步明确。
肝硬化患者肝癌的年发病率为1%~8%。不同病因所致肝硬化的5年累积HCC发病率依次为HCV感染30%、HBV感染15%~17%、酒精性肝硬化8%、原发性胆汁淤积性肝硬化4%。抗乙肝病毒治疗能使乙肝肝硬化患者肝癌发病率降低,但HCC年发病率仍达1.5%~2.5%。丙肝肝硬化患者在抗病毒治疗根除HCV感染后,可显著降低但不能消除进展为HCC的风险。
肝癌风险模型有益于肝癌高风险人群的分层识别。目前有多种适用于不同人群的肝癌风险评估模型,包括HBV相关的REACH-B模型,抗乙肝病毒治疗后的PAGE-B、SAGE-B、CAMD模型,多伦多肝癌风险指数的THRI模型、预测HCV、酒精性肝病(ALD)或NAFLD相关肝硬化的模型,以及适用于多病因肝癌风险评估的aMAP模型等。aMAP模型来源于多病因、多民族的慢性肝病队列分析,纳入年龄、性别、血清白蛋白与胆红素、血小板参数,aMAP评分大于60分者为肝癌高风险人群,约占慢性肝病的18%,其肝癌5年累积发生率近20%。可依此将慢性肝病患者人群进行分层管理,高风险人群纳入常规肝癌监测和随访管理,对低风险人群(aMAP小于50分者)不进行常规肝癌筛查,以将有限资源集中于肝癌高危人群,提高筛查效率。aMAP模型已建立小程序,通过扫描专用二维码、输入个人参数后小程序自动完成评分计算,方便居民或患者自我测评肝癌风险。
综上所述,我国肝癌筛查目标人群是CHB和各种原因导致的肝硬化患者,尤其是风险模型例如aMAP模型评估为肝癌高危人群。代谢相关脂肪性肝病已日益成为我国最主要的慢性肝病,其未来有可能替代CHB患者成为肝癌主要危险人群。
二、肝癌筛查与评估方法
肝癌筛查以提高早期肝癌发现率,继而提高肝癌5年生存率为目的。因此,肝癌筛查早诊流程包括慢性肝病筛查、肝癌高危人群诊疗分层与肝癌监测随访,简称筛查、诊疗、随访三个环节。
慢性肝病筛查针对我国高发病率的慢性乙肝、肝硬化和脂肪肝进行。手指微量血检测乙肝病毒表面抗原(HBsAg),可用于现场快速筛查出HBV感染者;B型超声(type-Bultrasonic,US)或肝瞬时弹性扫描可以现场筛出肝硬化或脂肪肝。目前肝瞬时弹性扫描仪可同时定量检测肝硬度值(LSM)和脂肪肝,稳定可靠、操作简单易学,尤其适宜于基层医疗机构或现场进行肝硬化和脂肪肝定量筛查。LSM扫描检测已在三级医疗机构常规用于肝病的诊断。
对肝癌高危人群的肝癌筛查技术方法仍沿用每6个月一次上腹部B型超声和甲胎蛋白(alpha-fetoprotein,AFP)检查。肝癌血清标志物除 AFP 外, 联合异常凝血酶原(des-gamma carboxy prothrombin,DCP/protein induced by vitamin K absence/antagonist-Ⅱ,PIVKA-Ⅱ)与甲胎蛋白异质体(AFP-L3),可提高早期肝癌筛出率。AFP对早期HCC的灵敏度为45.3%~62%,DCP≥40mAU/ml诊断早期肝癌的灵敏度和特异度分别为64%和89%。AFP-L3≥10%为肝癌诊断界值,诊断HCC的灵敏度和特异度分别为48.3%和92.9%。
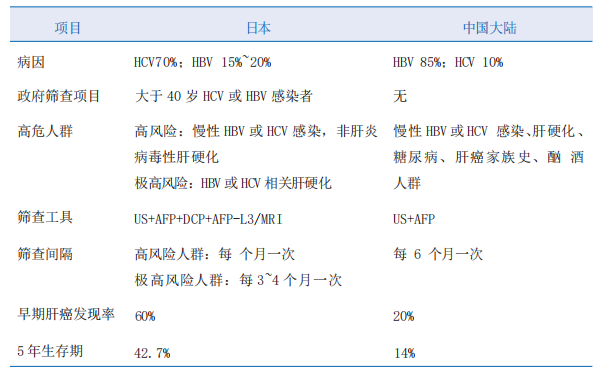
日本利用AFP、DCP和AFP-L3三联检结合定期MRI进行肝癌筛查,使早期肝癌发现率提高到60%。日本肝癌筛查早诊模式有借鉴意义,但因我国人群数量巨大、经济发展水平相对较低、基层医院MRI普及率及医保政策等差异大,不能照搬日本模式。中国大陆地区与日本肝癌筛查早诊现状比较见表1。我国人群开展肝癌筛查的经济学证据仍有限,初步提示AFP或HBsAg检测初筛评估出高风险人群后再行US可能具有成本效果,但整体经济性有待进一步明确。
US+AFP肝癌筛查技术模式,其成本和技术门槛决定了肝癌筛查不能采取在社区人群中无差别整群体筛查方式。从实施可行性考虑需要分步骤、精准分层、医院社区一体化实施。
表1 日本与中国大陆肝癌筛查早诊现状比较
三、肝癌筛查早诊实施
由于慢性肝病发病和疾病进展的隐匿性特点,仅20%左右患者在医院发现并接受诊疗,80%慢性肝病患者在社区未被发现呈隐匿性发展。因此,肝癌筛查早诊的实施分为医院和社区两部分。
医院内肝癌筛查早诊的实施有两个重点人群和两个步骤。两个重点人群,一是术前经过HBsAg和HCV抗体常规筛查阳性的患者;二是医院肝病专科日常诊疗的慢性肝病患者。医院已筛查出的慢性肝病患者,目前缺乏后续诊疗和随访环节的机制。术前常规筛查出的HBsAg或HCV抗体阳性者,需要医院建立统一导诊流程,督促乙肝或丙肝阳性者到相应专科(感染科或肝病科)进行诊疗。已有部分综合医院在探索开展以上慢性肝病患者的导诊流程,包括医院门诊、住院及检验信息系统的肝病阳性患者的信息便捷汇总收集,肝病阳性患者的导诊通知送达,专科接诊记录,医院专人负责管理督导。也有项目开展医院内肝病患者的家庭陪护人的肝病筛查。肝病专科日常诊疗的慢性肝病患者,需要按肝癌高危风险分层建立队列随访、开展常规肝癌筛查。以上探索试点的成功经验,需要借助相关学(协)会、医疗行政部门或肝病专业科室督促医院推广实施,建立院内肝病患者统一规范化的导诊、诊疗与随访流程,开展肝癌高危肝病患者的随访管理。
社区肝癌筛查早诊工作目前处于模式探索阶段。我国80%慢性肝病或早期肝癌患者“静默”在社区中,相较于医院来说,社区才是肝癌筛查工作的重点。我国社区卫生服务机构多建有“健康小屋”,用于建立居民健康档案,开展社区慢病管理。目前我国社区卫生服务机构承担政府委托的慢病管理服务包,主要包括老年居民体检,以及高血压、糖尿病(简称“老高糖”)和精神病患者的健康和疾病管理,并得到国家财政支持。慢性肝病尚未纳入国家社区卫生服务包,如何在健康小屋中加入慢性肝炎等慢性肝病筛查,并建立医院社区一体化的肝癌高危人群诊疗、慢病随访管理和肝癌监测早诊的分级诊疗,需要试点探索。广东省化州市和东莞市、江西于都县人民医院、福建省和海南省等地已先后启动以上试点工作。实施流程简介如下。
1.政府主导,包括地区政府发文确定方案、匹配经费、督导实施。
2.当地(区域医联体)的牵头医院相关科室负责实施。例如,江西于都县人民医院专门成立慢病随访科(12名专职人员),负责健康教育、下乡指导或现场筛查、导诊、随访管理,承接全国相关社区筛查项目;于都县人民医院感染科负责筛查出的肝病患者的诊疗,参与肝癌监测随访。
3.筛查阳性者导诊到牵头医院进行肝病诊疗,完善包括血液、B超或CT等检查,明确慢性肝病诊断,予以规范抗乙肝病毒等治疗。
4.肝癌高危风险评估分层(例如aMAP评分),对高危人群建立疾病档案,由肝病专科或感染科医生进行肝癌监测随访。
5.肝癌监测模式高危人群(肝硬化、aMAP评分大于60分),基线增强CT或MRI检查;其后每6个月一次B超+AFP监测。怀疑有癌变(AFP增高或肝DN结节明显增大)时进行增强CT或MRI检查。高度异型增生结节(high grade dysplastic nodule,HGDN)极高危人群,每3~4个月一次B超+AFP监测,每年一次增强CT或MRI,有条件者推荐用Gd-EOB-DTPA造影剂增强MRI。
四、肝癌早诊
肝硬化常有肝内再生结节(regenerative nodule,RN)、异型增生结节(dysplastic nodule,DN),包括低度异型增生结节(low grade dysplastic nodule,LGDN)及HGDN。LGDN、HGDN患者HCC的年发病率分别约为10%、20%,HGDN在1年、2~3年和5年内发展为HCC的转化率分别为6.2%、61.5%和80.8%,因此,HGDN可被认为是癌前病变。DN 向早期HCC(early HCC,eHCC)转变过程中,肝结节内的血液供应、细胞膜分子表达及细胞生物代谢特征均有渐进式变化。
肝癌临床诊断依据包括影像学特征+慢性肝病史+肝癌分子标志物,主要依赖动态增强CT或MRI影像学特征,尤其肝动脉供血的“快进快出”特征。但早期肝癌肝动脉供血特征不明显,需要肝细胞特异性造影剂(Gd-EOB-DTPA)增强MRI鉴别,其诊断直径≤1.0cm肝癌的灵敏度为69%~83%,特异度为46%~93%,结合MRI的DWI序列可鉴别肝硬化结节、LGDN、HGDN和eHCC,已成为肝硬化患者肝癌早诊的重要方法。
肝结节经皮肝穿刺活检获得病理诊断,但受到多方面限制,比如结节小,位置不易穿刺定位引导等因素,肝小结节穿刺活检假阴性率较高,临床实践中多不作为常规应用。
肝癌血液分子标志物检测及液体活检。AFP+DCP+AFP-L3三联检对早期肝癌灵敏度达77%,较AFP明显提高;但DCP与AFP-L3尚未在国内医院普及。血液中循环肿瘤DNA(ctDNA)检测技术,被称为“液体活检”技术,包括miRNA、cfDNA、甲基化DNA等,已逐渐试用于早期肝癌预警,在肝癌筛查早诊中的应用及价值有待研究。
五、肝癌筛查早诊相关问题和解决思路
肝癌筛查存在以下问题:高风险人群界定,筛查方案及筛查时间间隔,筛查和监测的概念混淆,缺少系统的卫生经济学评价及筛查质控等。
(一)社区筛查实施难点
社区卫生服务站(中心)、区(镇)医院、市(县)医院,构成区域三级医疗服务机构,其任务分级从以疾病预防控制为主,到以疾病诊疗为主。但三级机构间各自独立,包括承担任务独立,人员管理独立,支付独立,医疗电子病历系统与健康管理档案独立,疾病防和治呈独自分割管理的“两张皮”。社区卫生服务机构包括社区卫生服务中心、社区卫生服务站点或村卫生站,是由当地政府负责建立和管理,执行国家统一布置的公卫任务,包括疫苗接种、“老高糖”(老人体检、高血压、糖尿病)慢病管理,以及临时性的防疫、疾病筛查等任务,并获得政府委托任务的支付。为实现医防(卫)融合,各地开展区域医联体机制探索,包括牵头医疗机构负责各级机构的医务人员调度及待遇统一管理、地区医保资金使用交由地区牵头医院管理、医疗与预防任务统一管理。但以上机制目标尚未落实到慢病管理实际操作中,也无顶层设计和实施动力。目前可以慢性肝病社区管理项目形式推动区域医联体内的医防融合落地,建立可支付、可持续的长效机制。
(二)肝癌筛查效果评估
筛查效果评估包括筛查实施效果评估和终极目标5年生存率的评估。广东省中山市研究筛查评估生存率或死亡率,基线为35~64岁的17966人,HBsAg阳性者2848人每隔6个月进行US和AFP检测,入组50544名居民作为对照,随访4年后肝癌死亡率未观察到有统计学意义的改变。样本量小的肝癌筛查对肝癌死亡率影响小,提示肝癌筛查的生存率获益需要扩大筛查人群覆盖率,以及筛查与早诊早治需良好衔接(医防融合)。社区肝癌筛查实施的绩效评估包括目标人群筛查覆盖率、筛查阳性人群到医院诊治率和高危人群肝癌随访监测率。
(三)液体活检在亚临床肝癌的预警
有研究显示,液体活检技术能在临床诊断前3~6个月预警肝癌。临床诊断前的肝癌不妨称为“亚临床肝癌”,是指发生微小癌变,目前临床影像学诊断技术无法确诊的阶段。液体活检技术对AFP阴性或亚临床肝癌的诊断或预警,可以进一步加强对该类人群的肝癌监测,以提高早期肝癌的诊断发现率。目前肝癌临床诊断定位、治疗和治疗后评估主要依赖临床影像学技术,而亚临床肝癌尚不能定位肝癌病灶,继而难以实施提早治疗。因此,液体活检技术在肝癌筛查早诊的价值与地位尚待进一步研究,其高昂的价格也限制了其仅能应用于肝癌极高危人群。
(四)肝癌筛查的卫生经济学考虑
一项杭州市研究结果显示,每筛查出1例阳性者成本为8.4万元,成本效用比为每获得1个质量调整寿命年花费0.6万元。2012年金昌市研究显示,每筛查出1例可疑肝癌患者的成本为3万元。有2项初筛评估出高危人群后再行超声检查的研究,结果显示每检出1例肝癌患者的成本为8万元。
假设10万名20~70岁社区成人居民,采取HBsAg快速筛检,阳性者进一步诊断及肝癌风险分层评估(aMAP模型),仅对高危人群进行肝癌监测(每6个月一次B超+AFP)。按此方案筛出每1例肝癌患者的成本约2.25万元,可使肝癌患者5年生存率从13%提升到45%,医疗花费减少近一半。以上假设(理想计算)数据需要在社区筛查早诊基地验证。
(郭亚兵 王坤远)
参考文献
[1]ALLEMANI C, MATSUDA T, DI CARLO V, et al. Global surveillance of trends in cancer survival 2000- 14(CONCORD-3): Analysis of individual records for 37 513 025 patients diagnosed with one of 18 cancers from 322 population-based registries in 71 countries [J]. Lancet, 2018, 391(10125): 1023- 1075.
[2]WANG M, WANG Y, FENG X, et al. Contribution of hepatitis B virus and hepatitis C virus to liver cancer inChina north areas: Experience of the Chinese National Cancer Center [J]. Int J Infect Dis, 2017, 65: 15-21.
[3]FATTOVICH G, STROFFOLINI T, ZAGNI I, et al. Hepatocellular carcinoma in cirrhosis: Incidence and riskfactors [J]. Gastroenterology, 2004, 127(5 Suppl 1): S35-S50.
[4]AKINYEMIJU T, ABERA S, ALAM N, et al. The burden of primary liver cancer and underlying etiologies from 1990 to 2015 at the global, regional, and national level: Results from the global burden of disease study 2015 [J]. JAMA Oncol, 2017, 3(12): 1683- 1691.
[5]FAN R, PAPATHEODORIDIS G, SUN J, et al . aMAP risk score predicts hepatocellular carcinoma development in patients with chronic hepatitis [J]. J Hepatol, 2020, 73(6): 1368- 1378.
[6]ZHANG B H, YANG B H, TANG Z Y. Randomized controlled trial of screening for hepatocellular carcinoma[J]. J Cancer Res Clin Oncol, 2004, 130(7): 417-422.
[7]HAO X, FAN R, GUO Y B, et al. Establishing an integrated hospital-community pyramid for screening and achieving hepatocellular carcinoma early diagnosis and treatment. Zhonghua Gan Zang Bing Za Zhi, 2021, 29(4): 289-292.
[8]KOBAYASHI M, IKEDA K, HOSAKA T, et al. Dysplastic nodules frequently develop into hepatocellular carcinoma in patients with chronic viral hepatitis and cirrhosis [J]. Cancer, 2006, 106(3): 636-647.
[9]RENZULLI M, BISELLI M, BROCCHI S, et al . New hallmark of hepatocellular carcinoma, early hepatocellular carcinoma and high-grade dysplastic nodules on Gd-EOB-DTPA MRI in patients with cirrhosis: A new diagnostic algorithm [J]. Gut, 2018, 67(9): 1674- 1682.
[10]ZHOU J, HUANG A, YANG X R. Liquid biopsy and its potential for management of hepatocellular carcinoma [J]. J Gastrointest Cancer, 2016, 47(2): 157- 167.
[11]王悠清,王乐,汪祥辉,等.杭州城市居民常见癌症筛查成本分析[J].中国公共卫生,2020 ,36 ( 1 ): 12- 15.
医学博士 主任医师 教授
南方医科大学南方医院肝脏肿瘤中心 主任,二级教授
广东省医师协会肝脏病分会第一、二届 副主任委员
中华医学会肝病分会肝癌专委会 委员
中国临床肿瘤学会(CSCO)肝癌专家委员会 委员
中国“原发性肝癌诊疗指南”(2022/2024版)专家组成员
广东省基层医药学会肝癌防治专委会首届 主任委员
南方医院肝脏肿瘤MDT负责人
主持和参与国际国内多中心肝癌临床试验研究60余项
获得广东省科技进步一等奖2项
广东省援鄂首批医疗队队长(2020年2月)
南方医院援助北京“小汤山”医疗队队长(2003年)
免责声明
版权所有©人民卫生出版社有限公司。 本内容由人民卫生出版社审定并提供,其观点并不反映优医迈或默沙东观点,此服务由优医迈与环球医学资讯授权共同提供。
如需转载,请前往用户反馈页面提交说明:https://www.uemeds.cn/personal/feedback
来源:《中国肝癌多学科诊疗发展之路》 主编 樊嘉 人民卫生出版社 2023年12月第1版 ISBN 978-7-117-35956-6
作者:郭亚兵教授,南方医科大学南方医院肝脏肿瘤中心主任
编辑:环球医学资讯常路







 Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.