近20年来,细菌对抗菌药物的耐药性迅速上升,甚至出现几乎对所有抗菌药物耐药的广泛耐药菌及对所有抗菌药物耐药的全耐药细菌感染。目前临床使用的抗菌药物虽然有150种之多,但新型抗菌药物的研发却严重滞后,极大地影响了感染性疾病的预后。为了减少耐药菌的产生,优化抗菌药物暴露,充分发挥现有抗菌药物治疗潜力,抗菌药物代谢动力学/药效学(pharmacokinetics/pharmacodynamic,PK/PD)理论对于指导临床抗菌药物合理应用的重要性日益得到重视。
相较于健康人群和普通疾病患者,重症患者PK/PD数据明显不同。他们的病情发展相对较快,病程呈现出多变性以及较为明显的差异性,更易发生耐药菌感染,疾病的致死率也相对较高;特别是重症感染、感染性休克患者,由于休克、低蛋白血症、器官功能障碍及生命支持治疗的广泛应用等,使得重症感染患者抗菌药物的PK/PD指数很难达到理想的靶值【1】,增加了临床治疗失败和耐药发生的风险。因而在重症感染疾病的治疗过程中,需要结合其特殊的PK/PD来制订临床治疗方案【2】,以获得最佳的临床和微生物学疗效。
本节主要介绍抗菌药物PK/PD的基本概念、重症患者PK/PD的变化以及针对这一变化抗菌药物治疗的指导建议。
一、PK/PD概念及参数
药物代谢动力学(pharmacokinetics,PK)是应用动力学原理与数学模式定量描述与概括药物通过各种途径(如静脉注射、静脉滴注、口服给药、雾化吸入等)进入人体后的吸收(absorption)、分布(distribution)、代谢(metabolism)和排泄(elimination)的过程。抗菌药物的PK主要研究抗感染药物在人体内的过程,包括药物分布至组织和体液中可达到的药物浓度及其持续时间。抗菌药物的药效学(pharmacodynamic,PD)反映药物对某种细菌抑菌或杀菌活性的高低,即抗菌药物的疗效取决于体内感染灶中的药物能否达到有效浓度,并清除其中的病原菌。
(一)药代动力学(PK)参数
1. 血药峰浓度和达峰时间 血药峰浓度(peak concentration,Cmax)指给药后所能达到的最高血浆(血清)浓度。达峰时间(peak time,Tmax)指给药后达到Cmax所需的时间。与之对应的是血药谷浓度(trough concentration,Cmin)。
2. 药时曲线、药时曲线下面积和生物利用度 血药浓度数据(纵坐标)对时间(横坐标)作图,所得曲线称为药时曲线,是反映药物进入人体后其浓度随时间变化的动态曲线。该曲线下面积称为药时曲线下面积(area under the concentration,AUC),AUC代表药物在血液中的相对量,24h内稳态血药浓度时间曲线下的面积则为AUC24h。生物利用度(bioavailability,F)指某药物活性成分从制剂释放、吸收进入血液循环的程度和速度。通常以Cmax、Tmax表示吸收速度,以AUC表示吸收程度。F是评价药物制剂质量的一个重要指标,包括绝对生物利用度(同一药物血管外制剂AUC与静脉制剂AUC的比值)和相对生物利用度(同一药物待测制剂AUC与参比制剂AUC的比值)。口服及肌注等血管外给药后,吸收较完全者生物利用度高,反之则低。
3. 半衰期 半衰期(half life,T1/2)指血液中药物浓度或体内药量减低到1/2所需的时间。体内药量(或血药浓度)吸收、分布和消除一半所需的时间分别成为吸收半衰期、分布半衰期和消除半衰期。T1/2通常指药物消除半衰期,T1/2长的药物在体内消除缓慢。肾功能减退患者在应用主要经肾脏排出的药物时,药物排出减慢,T1/2明显延长,药物可在体内积聚。
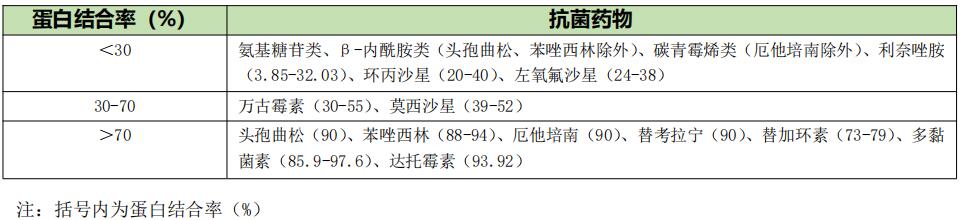
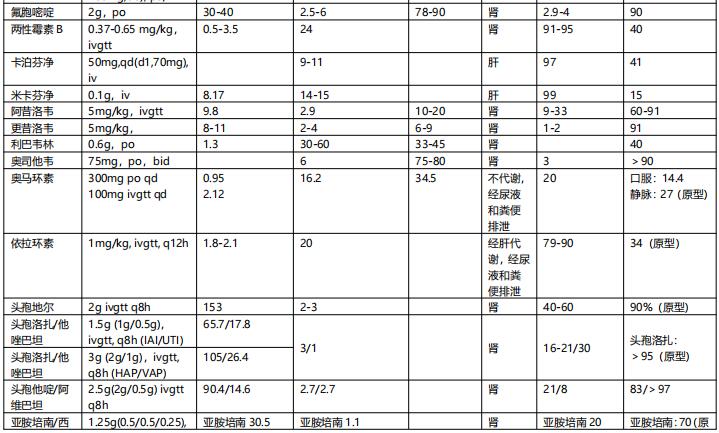
4. 表观分布容积、蛋白结合率 血药浓度与给药剂量或体内药量间的比值称为表观分布容积(apparent volume of distribution,Vd),反映了药物分布的广泛程度或与组织中大分子的结合程度。当药物的Vd>1L/kg时,说明药物的组织浓度高于血浆浓度,反之则低。亲脂性抗菌药物主要分布于脂肪组织,容易透过细胞膜进入细胞内,而亲水性抗菌药物不易通过脂质细胞膜,主要分布于血液与体液中,其Vd一般较小。另外,只有药物的游离型分子才能从血液向组织转运,并在作用部位发挥作用,若药物与血浆蛋白结合率(protein binding,PB)高,起效时间将受到显著影响。常将PB>70%、30%~70%和<30%的抗菌药物分别称为高、中、低PB抗菌药物。高BP抗菌药物在低蛋白血症时游离型药物增加,Vd可能增加,药物清除也会增加(表1)。
表1 常用抗菌药物的血浆蛋白结合率【1】
5. 清除率 清除率(clearance,CL)表示药物经肾、肝、肺和皮肤等各种途径自体内清除的速率。它能较T1/2更好地表示药物从体内清除的情况。总CL为肾清除率(renal clearance,CLr)和非肾清除率(nonrenal clearance,CLnr)的总和。肾功能损害时,某些经肾排泄的药物CL明显降低,清除减慢。药物自身的理化性质可影响药物的体内过程。抗菌药物的溶解性亦对Vd 产生影响,临床有时需要选择具有足够穿透性并在特定感染部位分布较大的抗菌药物。另外,抗菌药物的PB决定了游离型抗菌药物的浓度,也会影响抗菌药物的疗效。抗菌药物的主要清除路径也很重要,特别是在疾病状态下发生器官功能障碍或重症感染时,药物浓度会相应增加(如肾功能不全)或减少。抗菌药物体内PK过程的影响因素复杂,对其是否能迅速发挥作用或维持疗效应综合判断。
(二)药效学(PD)参数
1. 最低抑菌浓度(minimum inhibitory concentration,MIC) 是抗菌药物对病原菌抗菌活性的主要定量参数,指在体外培养基中可抑制细菌生长所需的最低抗菌药物浓度。
2. 最低杀菌浓度(minimum bactericidal concentration,MBC) 是指可杀死99.9%(Δlog10 CFU≥3)病原菌所需的最低药物浓度。MBC 与MIC 值比较接近时说明该药可能为杀菌剂。
3. 抗真菌药物最低有效浓度(minimum effective concentration,MEC) 在棘白菌素类抗真菌药物的抗丝状真菌药敏试验中,与自然生长的菌丝形态对照,能使菌丝形成小的、圆形的、致密的形态所需的最低抗真菌药物浓度。用以定量描述棘白菌素类对丝状真菌的抗真菌活性。
4. 防耐药突变浓度(mutant prevention concentration,MPC) 是指防止耐药突变菌株被选择性富集扩增所需的最低抗菌药物浓度。当抗菌药物浓度≥MPC时,可同时抑制敏感菌株和单次耐药突变菌株的生长,此时病原菌必须同时发生2次或更多次耐药突变才能继续生长。MPC值可判断抗菌药物防细菌耐药突变能力。细菌MPC与MIC之间的浓度范围为耐药突变选择窗(mutant selection window,MSW)(图1),在此范围内,耐药突变菌株更易被选择性富集。当治疗药物浓度高于MPC时,在保证疗效的同时也能防止耐药突变;药物浓度如果在突变选择窗内,即使抑制了敏感菌生长,临床治疗可能成功,但也可能导致耐药突变。
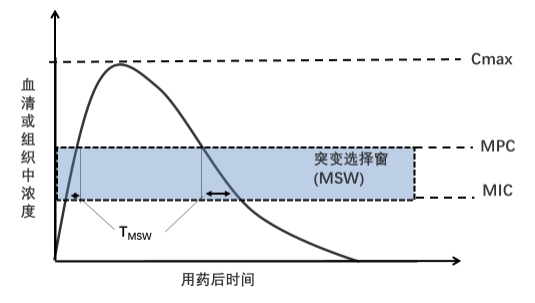
图1 耐药突变选择窗(MSW)示意图
5. 抗菌药物后效应(post-antibiotic effect,PAE) 既往称为抗生素后效应,是抗菌药物药效动力学的一个重要指标,是指抗菌药物与细菌短暂接触后,细菌受到非致死性损伤,当药物清除后,细菌恢复生长仍然持续受到抑制的效应。PAE的发生机制可能与作用在靶位的抗菌药物未解离而持续发挥作用,或是在抗菌药物打击下细菌生理功能缓慢恢复有关。PAE的大小反映抗菌药物作用后细菌恢复再生长延迟相的长短,亦反映抗菌药物作用于细菌后的持续抑制作用,故又称持续效应。PAE在不同抗菌药物和不同细菌中差异较大,且受抗菌药物浓度和作用时间等的影响。对于革兰阳性菌,几乎所有抗菌药物都有一定的PAE;对于革兰阴性菌,干扰蛋白和核酸合成的抗菌药物都有较长的PAE,多数β-内酰胺类对革兰阴性菌表现为短PAE或无PAE,但碳青霉烯类对革兰阴性菌仍有较长的PAE。
6. 抗菌药物后白细胞活性增强效应(post-antibiotic leukocyte enhancement,PALE) 是指在体内抗菌药物作用后,细菌形态发生变化,有利于增加白细胞识别趋化或吞噬活性,表现为体内PAE延长。
7. 亚抑菌浓度(Sub-MIC)效应 是指细菌直接暴露于低于MIC的抗菌药物浓度时,细菌生长仍可受到一定程度抑制的效应。
8. 杀菌曲线(time-kill curve) 抗菌药物的时效曲线。以菌落计数对数为纵坐标,药物作用时间为横坐标绘制出的药物作用时间-细菌浓度曲线,称为杀菌曲线。
9. 异质性耐药(hetero-resistance) 是指细菌耐药的一种特殊类型,指在体外的药敏实验中,某个单一分离菌株,在其培养的群体中存在着对某种药物敏感性不同的亚群,大部分亚群属于敏感,但有一小部分亚群属于耐药,以及极少数的亚群甚至出现高水平耐药。细菌的异质性耐药使药物对致病细菌治疗效果的评估带来了很大困难,使实验室MIC数据的可靠性降低(图2)。
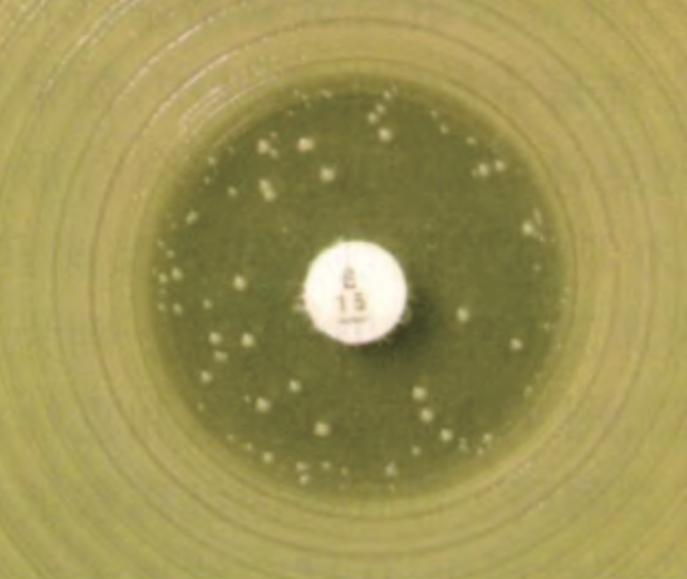
图2 异质性耐药【1】
10. 抑酶后效应(post β-lactamase inhibitor effect,PLIE) PLIE与PAE原理相似。β-内酰胺酶抑制剂单用时无后效应,但当β-内酰胺酶抑制剂与β-内酰胺类抗菌药物合用时,即使酶抑制剂被完全代谢清除,由于酶抑制剂与β-内酰胺酶产生不可逆竞争性抑制作用,细菌重新组合生成β-内酰胺酶需要一定时间。因此,在此期间,与酶抑制剂合用的抗菌药物仍然能发挥抗菌作用。PLIE代表了细菌产生的酶被β-内酰胺酶抑制剂抑制后,重新产生足够酶来水解β-内酰胺类抗菌药物所需的时间。
11. 抗菌药物折点:折点是药敏试验中用来判断菌株对抗菌药物的敏感性或耐药性的界值。根据试验方法的不同,折点可用浓度(mg/L或μg/ml)或抑菌圈直径(mm)表示。通常情况下,所有药敏试验均需依据折点将实验结果解释为敏感、中介或耐药。“折点”有多种解释:①野生型折点:指用于区分野生株菌群、获得性或选择性耐药菌群的MIC界值,有时也称为微生物学折点;②临床折点:用于区分预后良好的感染病原菌和治疗失败的感染病原菌,临床折点来源于感染患者的前瞻性临床研究;③PK/PD折点:来源于感染动物模型,并依据抗菌药物的PK/PD参数,通过数学或统计学方法推广至临床。
12. 剂量依赖性敏感(susceptible-dose dependent,SDD) 在药敏试验中,当菌株的药敏试验结果位于SDD区间时,意味着该菌株的抗菌药物治疗成功率取决于药物应用的剂量。对体外药敏试验结果为SDD的菌株如要达到临床疗效,有必要使用一个相对高于折点规定的参考药物的剂量(可通过使用增加剂量或高频率给药等方式实现)。当药物有多个批准的使用剂量时,建议对SDD的菌株治疗采用最大允许剂量,以保证达到最高的达标概率,同时需要参照说明书和器官功能进行剂量调整。
13. 联合抑菌指数(fractional inhibitory concentration index,FICI) 临床治疗重度细菌感染时常需要联合应用两种有协同或相加作用的抗菌药物。体外联合药敏试验计算FICI。FICI=MIC A药联用/MIC A药单用+MIC B药联用/MIC B药单用。当FICI≤0.5时提示协同效应,0.5~<1为部分协同效应,1为相加效应,>1~<4为无关效应,≥4为拮抗效应。
14. 血清杀菌效价(serum bactericidal activity,SBA) 指患者或健康人接受抗菌药物后一定时间(一般为达到Cmax时间)采集血清,测定能抑制细菌生长的最高血清稀释倍数。SBA与抗菌药物浓度呈正相关,与MBC呈负相关,是一个能综合反映抗菌药物PK/PD特性的重要参数。
(三)PK/PD
MIC或MBC并不能说明抗菌药物抑菌或杀菌活性持续时间的长短,也不能反映药物与细菌停止接触后是否有持续抗菌作用或PAE等。因此,只有将PK和PD两者结合,根据PK/PD指数,才能制定有效的治疗方案,达到最佳的临床和微生物学疗效,并防止治疗中的细菌产生耐药性。据此,对抗菌药物进行分类以指导临床合理应用。
1. 浓度依赖性 该类药物对致病菌的杀菌效应和临床疗效取决于Cmax,而与作用时间关系不密切,即血药Cmax越高,清除致病菌的作用越迅速、越强,且PAE可能延长。评估此类药物的PK/PD指数主要有Cmax/MIC或AUC24h/MIC。因此,提高此类抗菌药物疗效的策略主要是提高血药Cmax,一般推荐日剂量单次给药方案,但对于治疗窗较窄的药物需注意不能使药物浓度超过最低毒性剂量。
2. 时间依赖性 该类药物的抗菌效应与临床疗效主要与药物和细菌接触时间密切相关,而与浓度升高关系不密切,当血药浓度高于致病菌MIC的4~5倍以上时,其杀菌效能几乎达到饱和状态,继续增加血药浓度,其杀菌效应不再增加。评估此类药物的PK/PD指数主要有%T>MIC。对于时间依赖性抗菌药物应以提高%T>MIC来增加临床疗效,一般推荐日剂量分多次给药和(或)延长滴注时间的给药方案。延长滴注时间优化β-内酰胺类的给药方案需要关注抗菌药物在输液中的稳定性,对于不稳定的时间依赖性抗菌药物可以考虑增加给药频次。
3. 时间依赖性且抗菌作用后效应较长 该类药物虽然为时间依赖性,但由于PAE或T1/2β较长,使其抗菌作用持续时间延长。评估此类药物的PK/PD指数主要为AUC24h/MIC。一般推荐日剂量分2次给药方案。
4. 抗真菌药物PK/PD 抗真菌药物PK/PD的分类定义同抗细菌药物,仅PAE在抗真菌药物中称为PAFE。
(四)治疗药物监测
治疗药物监测(therapeutic drug monitoring,TDM)是临床药理学的重要组成部分。TDM通过测定患者治疗所用药物在血液或其他体液内的浓度,根据PK原理和计算方法,拟定适用于不同患者的最佳个体化给药方案,包括给药剂量、给药间期和给药途径,以提高疗效和降低不良反应,从而达到安全、有效的治疗目的。抗菌药物广泛用于临床上各种不同感染性疾病的治疗,对于某些毒性大的抗菌药物进行TDM,并据此进行个体化给药,是提高感染性疾病治愈率、降低毒性反应的重要措施。
一般以下几种情况需要进行抗菌药物的TDM【2】:①药物毒性大,其治疗浓度与中毒浓度接近;②有脏器功能损伤的患者,肝、肾功能减退影响药物的代谢和排泄,可导致药物在体内积聚;③某些特殊部位的感染,确定感染部位是否已达到有效药物浓度或浓度过高,浓度过高有可能导致毒性反应的发生,如测定青霉素在脑脊液中的浓度;④具有非线性PK特征、个体差异大、易发生药物相互作用的药物,如抗真菌药物伏立康唑、伊曲康唑和泊沙康唑;⑤在常用剂量下患者无治疗反应者,宜测定血药浓度。如重症感染患者由于病理生理改变导致其PK变异大,耐药菌感染的疗效欠佳。
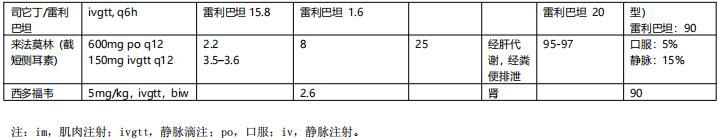
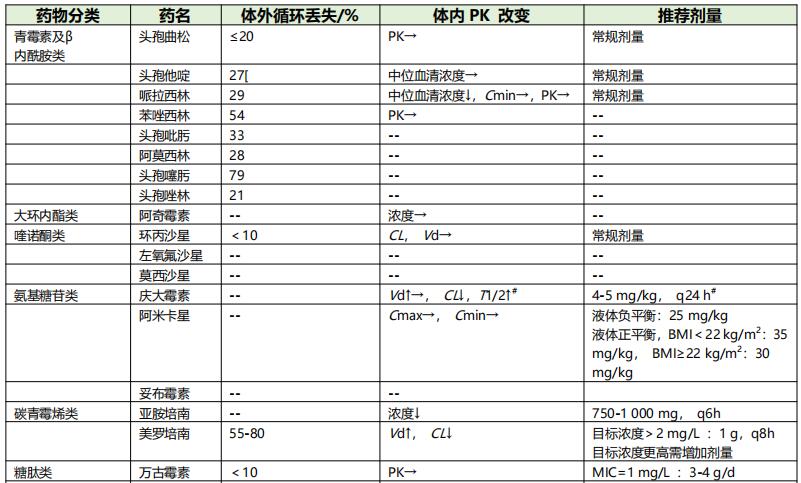
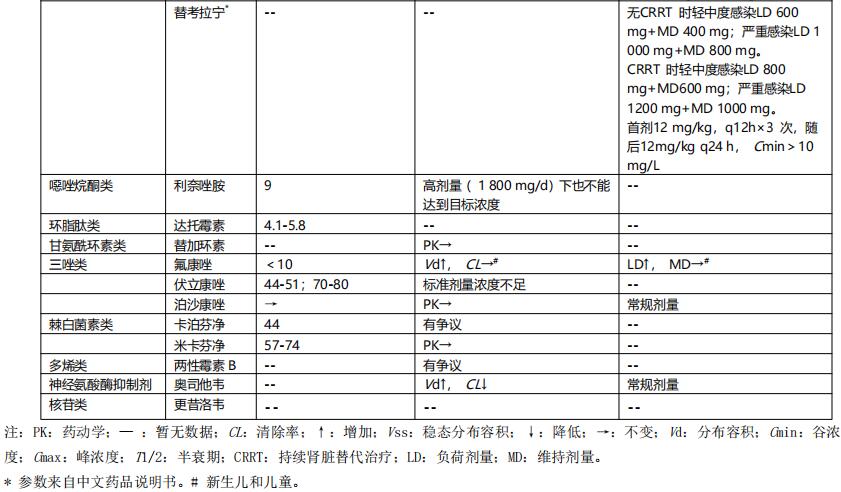
常见抗菌药物的可能中毒浓度、PK/PD指数与靶值、重症感染时主要药代动力学参数分别见表2、表3和表4。
表2 抗菌药物的治疗浓度范围和可能中毒浓度(mg/L)【2】
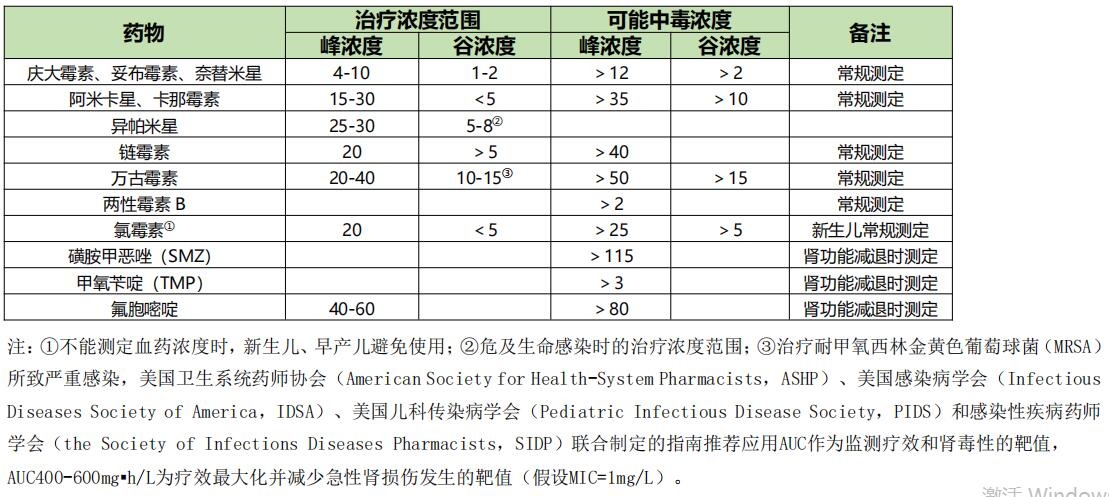
表3 常见抗菌药物PK/PD指数及靶值
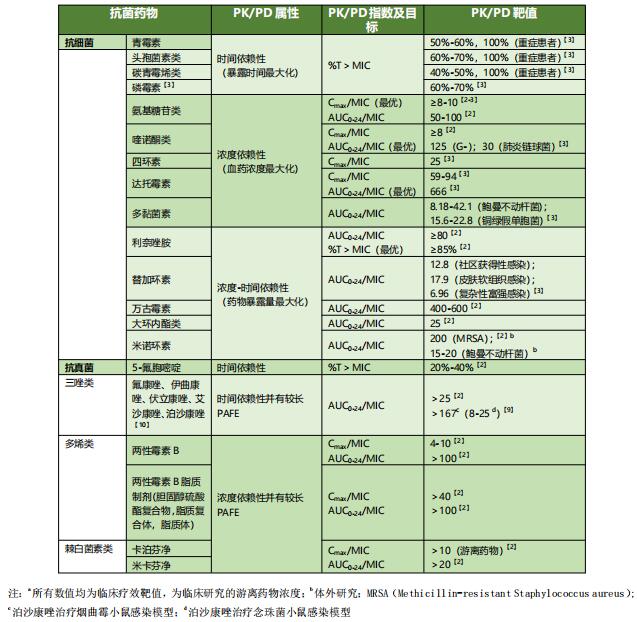
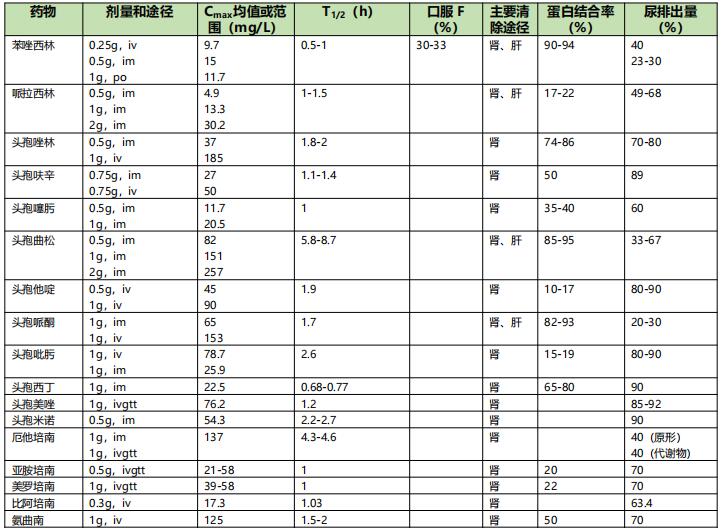
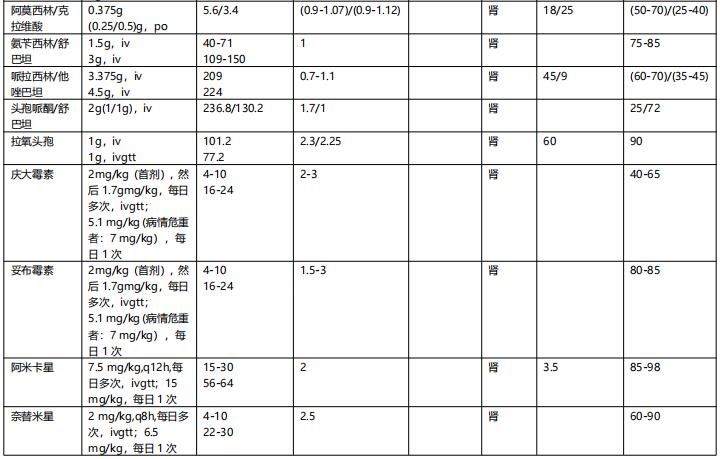
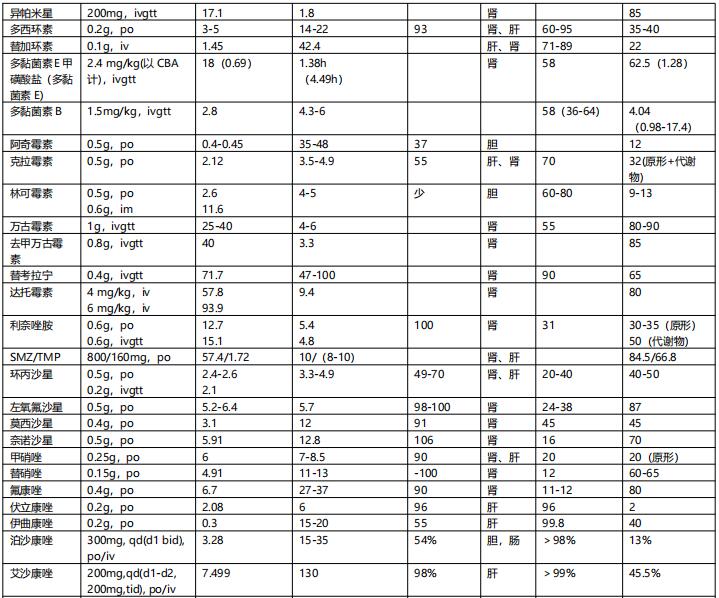
表4 重症感染常用抗菌药物主要药代动力学参数一览表【2】
二、重症患者特殊的病理生理变化对抗菌药物PK/PD的影响
重症患者,特别是重症感染、感染性休克的患者,由于病情严重程度、个体差异、休克、低蛋白血症、器官功能障碍及器官支持治疗手段等均可影响患者的PK,使得重症感染患者抗菌药物的PK/PD指数很难达到理想的靶值,是对临床抗感染治疗的严峻挑战(见图3)。
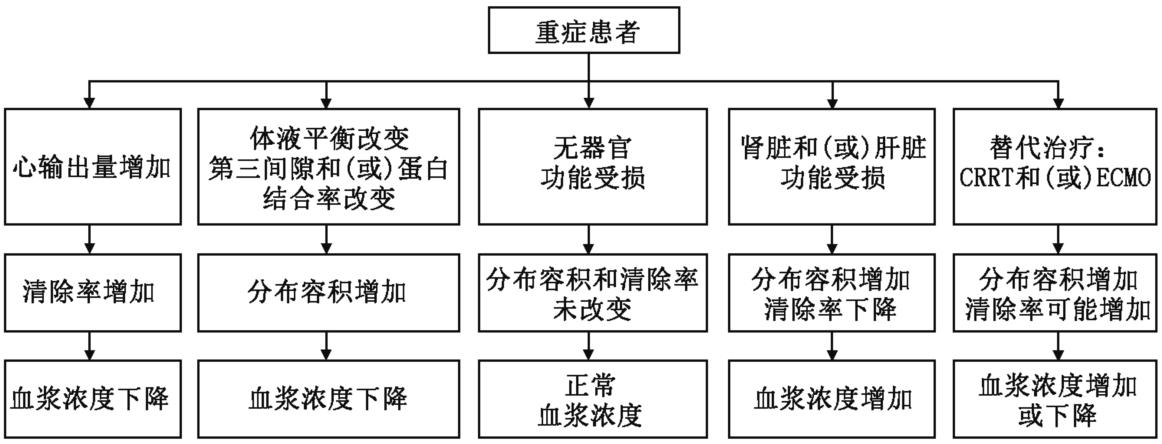
图3 影响重症患者抗菌药物PK/PD的因素
(一)多重因素影响抗菌药物在重症患者体内的PK
1. 治疗初期(见图4)
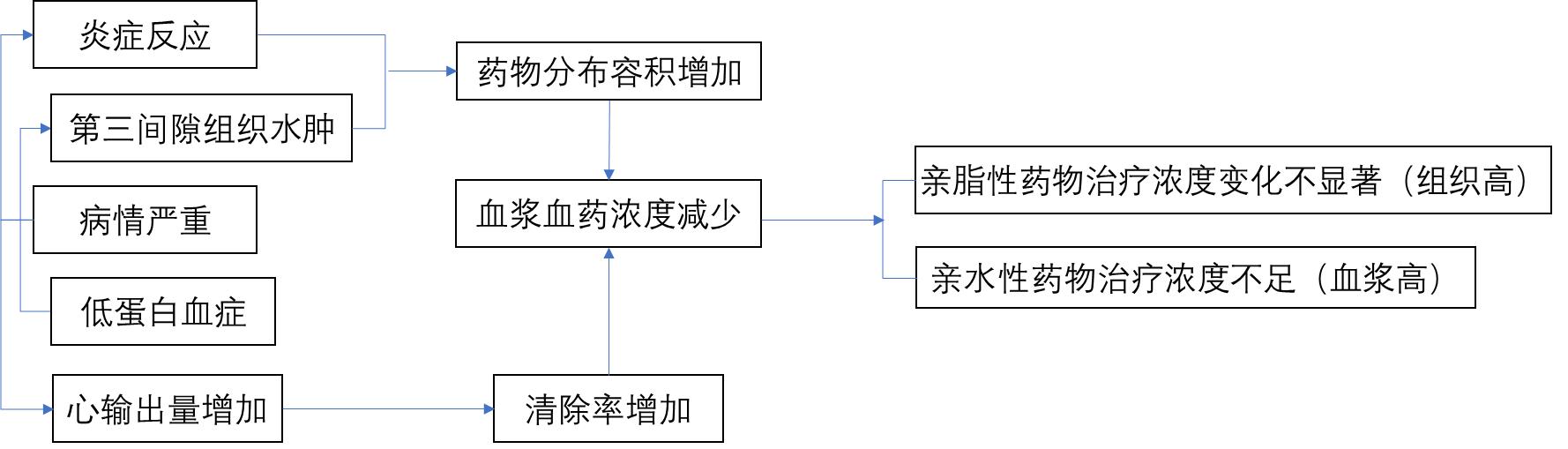
图4 重症患者治疗初期PK/PD变化
(1)炎症反应、组织水肿导致Vd增加:重症感染或感染性休克时炎症介质大量释放,使毛细血管通透性增加,大量的液体进入第三间隙,组织水肿明显,显著增加药物的Vd,致血浆药物浓度下降。亲脂性药物在组织中浓度较高,因此当患者病情加重时Vd较基础情况变化并不显著;而亲水性药物在血浆中药物浓度高,Vd小,当患者病情加重时药物的血浆浓度降低,药物向组织中的分布增加,Vd明显增大,此时药物的治疗浓度不足,治疗效果不佳。
(2)病情严重程度:与健康志愿者和普通患者相比,一般重症感染患者抗菌药物的Vd显著增加,且病情越严重、感染越严重,炎症反应越强,血浆蛋白水平越低,药物向组织中的分布增加越明显。重症感染患者常合并肝肾功能障碍,使药物清除减少。
(3)血流动力学状态:“高排低阻”是感染性休克典型的血流动力学特点,明显增加的心输出量使肝脏、肾脏血流量增加,从而经过肝脏和(或)肾脏的药物清除显著增加。
(4)低蛋白血症:低蛋白血症对抗菌药物PK的影响很少被关注,但对于临床医生却非常重要,特别是重症医生,其主要影响高PB的抗菌药物如头孢曲松和替考拉宁等。重症患者低蛋白血症的发生率高,第三间隙组织水肿明显,导致药物Vd显著增加;低蛋白血症时,游离药物增多,可使药物清除率增大,AUC/MIC及T>MIC均减小,尤其对T>MIC影响最大。①只有未结合的药物(药物的游离部分)才能发挥作用;②抗菌药物在组织中的分布取决于未结合药物的浓度,即抗菌药物的Vd、白蛋白-药物复合物与未结合药物形成动态平衡,在条件改变时白蛋白-药物复合物可进一步解离以增加未结合药物的浓度;③只有未结合的药物可以被肝脏或肾脏清除,因此血清白蛋白水平对高PB药物的Vd与清除均有显著的影响。低蛋白血症可使游离抗菌药物浓度升高,从而使抗菌药物的清除率出现不同程度的升高;此外,低蛋白血症还可增加抗菌药物的Vd,进一步减低血清药物浓度。
(5)器官支持治疗手段:持续肾脏替代治疗(continuous renal replacement therapy,CRRT)及体外膜氧合(extracorporeal membrane oxygenation,ECMO)等器官功能支持手段应用越来越广泛,可影响药物的清除,详见下述各分论的论述。
2. 治疗时期(见图5)
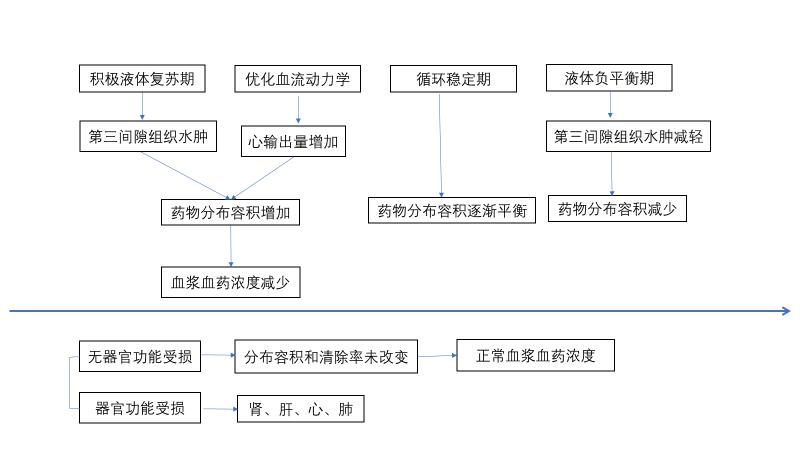
图5 重症患者治疗时PK/PD变化
液体复苏:感染性休克患者的液体管理分为4个阶段,每个阶段对抗菌药物Vd的影响不同。
第一阶段:积极液体复苏期:感染性休克早期需要快速补液、恢复有效循环血量,同时大量炎症介质释放,致血管通透性增加,液体进入第三间隙,抗菌药物Vd较之前显著增加,因此药物治疗浓度需调整,特别是负荷剂量。
第二阶段:优化血流动力学阶段:评估容量反应性和心脏泵功能,滴定容量状态,提高心输出量和氧输送,此时Vd仍较高,需特别关注药物维持剂量。
第三阶段:循环稳定期:休克逆转,没有组织低灌注表现,血管活性药物开始减量,不再需要大量补液甚至出现负平衡,抗菌药物的Vd开始逐渐下降。
第四阶段:液体负平衡期:休克逆转,第三间隙水肿减轻,抗菌药物Vd显著下降。第三和第四阶段在关注药物维持剂量的同时,需同时注意患者器官功能情况对药物浓度的影响。
(二)肾功能损伤
1. 急性肾损伤(acute kidney injury,AKI) 肾功能损害可导致抗菌药物PK/PD的改变,同时部分抗菌药物也可加重肾脏损伤,AKI合并感染患者抗菌药物的PK与正常人相比有如下特点(图6):
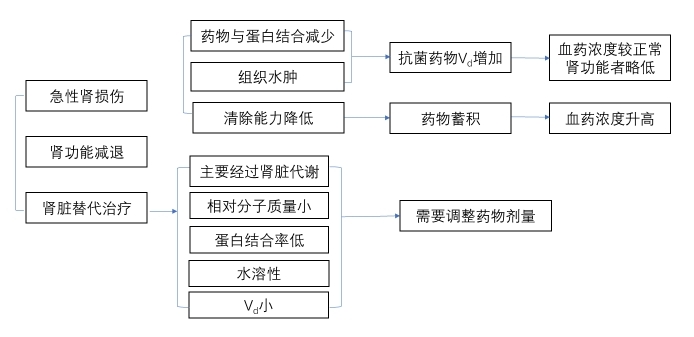
图6 重症患者肾功能损伤时PK/PD变化
(1)分布:对于AKI患者来说,一方面由于血清白蛋白合成减少或血清蛋白细胞外移增加,体内抗菌药物与血清蛋白结合减少,导致抗菌药物Vd增加;另一方面,血清蛋白减少可致组织水肿,使抗菌药物的Vd进一步增加。在脓毒症AKI过程中,毛细血管渗漏、液体复苏、静脉营养等均可使液体量过大,抗菌药物的Vd明显增加。药物的PB和亲水亲脂特性等均可影响Vd的改变。
(2)代谢:AKI如合并肝脏功能障碍时,将进一步影响某些抗菌药物(如唑类抗真菌药物)的代谢。
(3)排泄:多数抗菌药物经肾脏排泄,发生AKI时,抗菌药物的清除能力降低,排泄时间延长。
2. 肾功能减退时对抗菌药物体内清除过程的影响 主要经肾脏排泄的药物受影响最大。药物清除的减少可使血药浓度增高,可使药物在体内的分布过程发生相应改变。严重肾功能减退者的药物吸收过程亦受到影响。
(1)清除:抗菌药物在体内经肾和非肾两条途径清除,清除速率常数前者以Kr,后者以Knr表示,总清除速率常数Kel=Kr+Knr。一些抗菌药物在肾功能正常时,其Kr远超过Knr;肾功能减退时,由于Kr的降低,则使Kel亦相应下降。如肾功能正常时Knr远超过Kr者,则肾功能减退时对Kel无明显影响或影响很小。肾清除速率的降低导致药物T1/2ke(T1/2ke=0.693/Kel)延长,使体内药物消除减慢,血药浓度升高。对于一些毒性大的抗菌药物,即其毒性反应与血药浓度密切相关者,如氨基糖苷类,必须调整药物的维持量。但通常首次剂量(负荷量)仍可按原量给予,尤其在药物T1/2明显延长的情况下,给予首剂负荷量以尽快达到体内有效浓度对治疗严重感染至关重要,随后的维持量再根据肾功能状态进行调整。
(2)吸收:肾衰竭时,药物的吸收速率及吸收程度均可降低。口服或肌注时药物吸收均减少,与患者的一般情况差有关。因此,肾衰竭伴严重感染者均宜静脉给药。
(3)分布:肾功能减退时,药物的Vd可因多种因素影响而发生变化,如水肿、脱水。又如血浆白蛋白降低使药物与蛋白的结合量减少,药物游离部分增多,致Vd增大,但最终血药浓度一般仍较正常肾功能者略低;但如果出现严重肾功能损害则血药浓度会明显增加。
(4)代谢:药物经肾小管分泌或肝代谢后,极性大多增高,成为易溶的代谢物自肾排泄。肾功能减退时,该类代谢产物可在体内积聚。生物转化的结果常使药物抗菌活性降低或消失,而毒性则升高。肾功能减退时,许多药物的体内代谢过程尚不清楚,有待于进一步研究。
3. 持续肾脏替代治疗 CRRT已广泛应用于重症患者,一般情况下,水溶性、PB低、Vd小、相对分子质量小、主要经过肾脏代谢的药物容易在CRRT 时被清除,需要调整剂量;反之,不经过肾脏代谢、PB高、脂溶性和Vd大、相对分子质量大的药物,CRRT对药物的清除有限,一般不需要调整剂量。
(1)患者相关因素:年龄、性别、体重、感染严重程度、肝肾功能障碍、严重低蛋白血症等均可明显影响药物的PK和PD。
(2)抗菌药物自身特性及清除途径:
1)药物自身特性对CRRT时药物清除的影响:如相对分子质量<5000的药物可通过弥散作用被清除,相对分子质量越小,通过透析清除的速度越快。血液滤过主要通过对流对药物进行清除,后者主要与超滤率有关,超滤率越大,清除率越高,与相对分子质量大小关系较小。Vd越小,药物在血液中的浓度越高,CRRT时越容易被清除;Vd越大,CRRT时越不易被清除。药物的PB越高,游离状态的药物越少,CRRT对药物的清除影响越小;相反,则CRRT对药物的清除率大。目前临床所用大多数滤器的血液侧带正电荷,能吸附带负电荷的抗菌药物,此类药物的清除增加。药物的相对分子质量、PB、电荷及滤过膜的特性均可影响筛过系数(sieving coefficients,Sc)。Sc越接近0说明药物越难被清除;越接近1,则药物越容易被清除。
2)药物清除途径的影响:通常药物的清除是肾脏清除(ClR)、肾外器官清除(ClNR)和体外清除(ClEc)的总和。若药物主要通过肾脏清除,则在AKI时CRRT可能是该药物的主要清除途径,须关注药物剂量的调整;若药物清除以肾外途径为主(如主要经肝脏清除),CRRT对药物的清除影响不大,一般不需调整剂量。CRRT的体外清除率对于β-内酰胺类、氨基糖苷类、糖肽类等水溶性抗菌药物更有意义【3】,对于非肾清除的脂溶性药物如氟喹诺酮类、噁唑烷酮类的清除作用较小。头孢曲松和苯唑西林虽然是亲水性的,但由于其主要靠胆汁排泄,故正常状态下一般不会被CRRT清除,受影响较小;Kroh等研究表明,接受持续性静脉-静脉血液滤过(continuous venovenous hemofiltration,CVVH)治疗患者的头孢曲松肾清除率、表观分布容积及半衰期等与肾功能正常人群相近,提示CRRT治疗时不需调整剂量。虽然左氧氟沙星和环丙沙星有较强的脂溶性,但主要经肾脏排泄,有可能被CRRT清除。
(3)CRRT滤器及治疗参数:
1)滤膜的特性:滤膜的孔径决定滤膜的最大截留(cutoffs)相对分子质量,一般在35000~55000,最大截留相对分子质量越大,抗菌药物清除越快。一般高PB的抗菌药物不易被清除,但近年来研发的高通透性滤膜最大截留相对分子质量>60000,使得高PB抗菌药物的清除显著增加。滤膜的面积越大,对药物的清除越多。滤膜的吸附能力也是CRRT清除溶质的途径之一,包括滤膜材质、滤膜面积、滤膜所带电荷、滤器使用时间。滤膜两侧跨膜压越大,对药物的清除率越高。于斌等【3】采用AN69-M100磺化聚丙烯腈膜血滤器,在CVVH模式下,置换液实际用量达到(31.63±1.48)mL·kg-1·h-1时,25例患者亚胺培南的总清除率为(8.874±2.828)L/h,CRRT对体外亚胺培南的总清除率为(2.211±0.539)L/h,占总清除率的(30.1±15.7)%。AN69-M100磺化聚丙烯腈膜为高通量滤膜,最大截留面积较大,且其膜面积可达0.9m2,对于相对分子质量为299.34的亚胺培南来说很容易通过。
2)CRRT模式:主要通过肾脏清除的药物(如β-内酰胺类)持续静脉-静脉血液透析滤过(continuous venovenous hemodiafiltration,CVVHDF)的清除效率高于CVVH。对于非肾脏清除药物,CRRT对其清除影响小。各种CRRT模式对清除率影响区别不明显,如伏立康唑主要通过肝脏代谢,PB高,Vd大,CVVHDF清除只占药物总清除率的(11±7)%,CVVH和CVVHDF之间亦无显著差异【3】。
3)CRRT治疗剂量:置换液量、前稀释、后稀释、负平衡、血流速和红细胞压积等均可影响CRRT治疗剂量(超滤率)。治疗剂量越大,药物清除速度越快,如置换液量越大、超滤率越高、头孢他啶的清除越多。
4. 肾功能不全合并急性肝功能损伤对抗菌药物PK的影响 一方面肝功能障碍时常合并肾脏功能损伤,另一方面急性肝损伤可能与AKI同为创伤、脓毒症等引起的器官损害,此时抗菌药物的清除将明显减少。
(三)肝功能受损
肝脏是人体最大的腺体,其功能十分复杂。许多药物包括抗菌药物经由肝脏进行生物转化、解毒和清除。与慢性肝功能损伤相比,急性肝功能损伤患者一般不存在门脉高压和大量腹水,对口服药物的吸收代谢、水溶性药物的体内分布影响均较小,主要是影响静脉药物的代谢和清除。另一方面部分抗菌药物原本就有引起急性肝功能损伤的风险。至今,抗菌药物在肝功能减退时应用的相关资料较少,肝功能减退时抗菌药物的选用十分复杂(图7)。
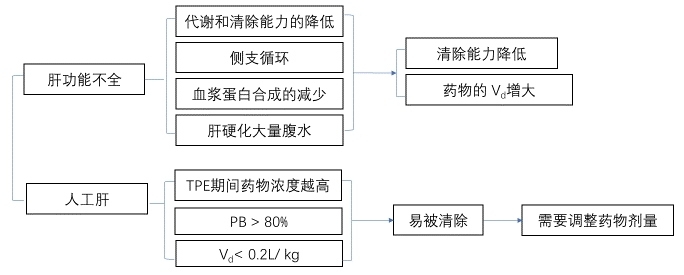
图7 重症患者肝功能不全时PK/PD变化
1. 肝病时的药代动力学改变 药物在肝内的代谢有两期,第1期是药物在肝脏氧化还原酶或水解酶的作用下被氧化还原或水解,所产生的代谢物的生物活性与母药不同,并可产生毒性;第2期则是在肝脏转移酶的作用下,代谢物与葡萄糖醛酸、谷胱甘肽等形成极性增加、可溶解的代谢物,易从胆汁或尿液排泄,此期产生的代谢物大多毒性较低。药物在肝内代谢过程中CYP450 是最重要的药物代谢酶。药物代谢可属第1期,也可属第2期,或两期兼有。
由于肝脏具有相当大的代偿能力,因此,仅在肝功能严重受损时才发生抗菌药物PK的明显改变,主要由下述因素引起:肝脏自身代谢和清除能力的降低;肝硬化门脉高压侧支循环的建立,减少了药物经肝脏的代谢和解毒作用;肝病时,药物与蛋白质亲和力的降低、血浆蛋白合成的减少等均使药物游离部分增加;肝硬化有大量腹水时,细胞外液量增加,致药物的Vd增大;肝硬化门脉高压时,胃肠道淤血、水肿影响口服药物的吸收过程。
肝脏损害部位的不同对药物代谢的影响程度亦不同。如病变累及肝小叶,则影响明显,除多见于病毒性肝炎外,还可见于酒精性肝炎患者。但在原发性胆汁肝硬化的早期,病变主要累及门脉区,对药物肝内代谢的影响并不明显。至终末期肝实质受损时,才表现为肝脏代谢药物能力的减退。
某些药物对肝脏药酶有诱导作用,如利福平在疗程中的血药浓度可因药物肝内代谢加速而降低。但在肝功能损害者,对肝药酶的诱导作用减弱,血药浓度就明显高于正常人。
2. 体外肝脏支持技术 人工肝是暂时替代肝脏部分功能的体外支持系统,通过体外的机械、理化和生物装置,清除各种有害物质,补充必需物质,改善内环境,为肝细胞再生及肝功能恢复创造条件,或作为肝移植前的桥接。人工肝分为非生物型、生物型和混合型,而非生物型人工肝是行之有效的体外肝脏支持技术,主要包括血浆置换(therapeutic plasma exchange,TPE)、血液吸附、血液灌流及分子吸附再循环系统(molecular absorbent recirculating system,MARS)等,这些方法均通过特殊滤器将大部分血浆成分在体外进行分离、置换和吸附,达到清除体内大分子物质的目的,同时也能清除部分抗菌药物,影响其疗效和安全性。
目前临床上最常用的、最易实施的人工肝是TPE,其对抗菌药物PK/PD影响的研究也最多。TPE是利用大孔径中空纤维膜分离技术,将血液中含有毒素的成分(主要为蛋白结合毒素)滤出膜外,因此TPE对抗菌药物PK的影响主要表现在药物清除的改变,主要与抗菌药物内在的PK参数及TPE的进程有关。
(1)抗菌药物内在的PK参数:抗菌药物的Vd和PB与TPE有关,Vd<0.2L/kg和PB>80%的药物易被TPE清除。
(2)TPE参数的设置:TPE的持续时间、置换总量和频次均可影响抗菌药物的清除总量。置换时间越长,置换频次越多,置换总量越大,药物清除越多。另外,药物开始滴注的时间与TPE开始时间的间隔也影响药物的清除,间隔越短,药物在体内尚未完全分布到血管外组织就被清除出体外,药物浓度明显降低。抗菌药物在TPE中清除的重要决定因素:①药物相关:在TPE期间药物浓度越高,越容易被清除(药物分布半衰期);PB越低,越不容易被清除;Vd越大,越不容易被清除。②TPE相关:TPE的持续时间、成功进行TPE的频次、TPE置换总量及TPE置换的液体种类。
目前MARS主要在欧美国家使用,国内也有不少大型医院开展,临床研究结果显示,MARS与其他体外肝脏支持技术比较,对毒素、胆红素及血氨的清除效能最佳。MARS是通过白蛋白透析清除蛋白结合毒素和水溶性毒素。MARS对抗菌药物PK影响的研究很少,且均为个案报道或仅涉及个别抗菌药物。而在体外比较了MARS与CVVHDF对抗菌药物血浓度的影响,结果显示,头孢曲松(高PB、低Vd)和替考拉宁(高PB、高Vd)在MARS的6h后血药浓度下降幅度显著高于CVVHDF,而头孢他啶(低PB、低Vd)和左氧氟沙星(低PB、高Vd)在MARS与CVVHDF的血药浓度下降幅度相同,两者的清除均与透析流速密切相关。由此可见,MARS主要增加PB高的抗菌药物的清除,而与抗菌药物的Vd关系不大,同时MARS的持续时间、白蛋白透析总量等亦可影响抗菌药物的清除。
(四)心功能不全
急性心力衰竭(ctute heart failure,AHF)通常由原发性心脏病或慢性心力衰竭急性加重引起,虽然其主要病变器官为心脏,但可通过影响组织供血、供氧和液体潴留而导致全身器官功能不全(见图8)。
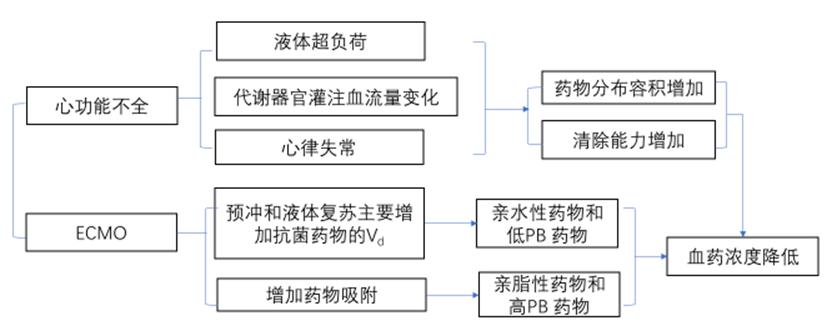
图8 重症患者心功能不全时PK/PD变化
1. AHF对抗菌药物排泄的影响
(1)AHF和心源性休克:通过血流动力学障碍影响其他器官功能血流量及代谢能力,代谢器官的灌注血流量变化影响抗菌药物的清除率,导致药物半衰期变化。
(2)AHF和心源性休克影响药物的Vd:AHF存在液体超负荷,表现为肺水肿、脏器淤血、外周水肿及第三间隙积液等,引起Vd变化。此外,28.9%的AHF患者合并低蛋白血症,感染又增加其发生率,加重渗液及组织水肿。血管内液体转移至组织间隙,致组织间隙体液过剩,使亲水性抗菌药物的Vd增大,从而降低血药浓度。当AHF合并胃肠道淤血时也可影响口服抗菌药物的吸收。
2. 对心脏有不良反应的抗菌药物 抗菌药物对心脏的不良反应主要为心律失常,其中Q-T间期延长和尖端扭转型室性心动过速(torsades de pointes,TdP)因高死亡风险而备受关注。药物通过影响心肌动作电位2相钾离子外流导致Q-T间期延长,进而引起室性早搏,并促发TdP,甚至心室颤动及心源性猝死。可引起Q-T间期延长和TdP的常用抗菌药物包括大环内酯类、喹诺酮类及唑类抗真菌药,其中大环内酯类(PD及PK双重机制)及个别喹诺酮类引起Q-T间期延长及TdP的危险性较大,如再合并其他危险因素则进一步增加Q-T间期延长及TdP的发生率。这些危险因素包括女性、器质性心脏病、低血钾、合用多个延长Q-T间期的药物(如胺碘酮)及过量、合用影响药物代谢的药物(如经CYP3A4代谢药物)、长Q-T间期或先天性长Q-T间期综合征家族史、肝功能损伤等。也有报道部分头孢菌素类药物可致室性早搏、频发多源型室性早搏及TdP【4】。
3. 体外膜氧合技术 ECMO是将经氧合器氧合后的静脉血通过静脉或动脉泵回体内,为急性呼吸或循环衰竭的重症患者提供器官功能支持的方法。使用ECMO的患者往往需要抗菌药物治疗,由于体外循环、药物及患者相关因素等的影响,抗菌药物的PK/PD常发生改变【5】。但目前国内关于ECMO患者抗菌药物的PK/PD研究不多,其影响重症患者抗菌药物PK/PD的主要机制包括:
(1)ECMO相关因素:①改变药物Vd:ECMO时,预冲和液体复苏主要增加抗菌药物的Vd,使血药浓度下降。氨基糖苷类(如庆大霉素和妥布霉素)的PB低、亲水性高,重症患者的Vd明显增加,ECMO使Vd进一步加大,故需要较高负荷剂量。因此,对于Vd小的亲水性药物建议ECMO 时增加负荷剂量。②增加药物吸附:ECMO管路和膜肺直接对药物的吸附作用可造成药物被吸附扣留,降低血药浓度。ECMO对不同药物的吸附存在差异,主要与膜的材料和药物本身的性质有关,特别是对亲脂性药物和高PB药物影响较大。吸附增加药物的Vd,降低血药浓度。如伏立康唑因其脂溶性强,ECMO时血药浓度发生显著变化,给药后24h的吸附率高达71%,需要增加负荷剂量和维持剂量。卡泊芬净体外实验结果显示回收率下降,可能与ECMO膜肺和管路表面的吸附有关。两性霉素B脂质体蛋白结合力高,可能因吸附等因素导致血药浓度下降。氟康唑PB低,不受ECMO膜肺和管路吸附的影响,其在24h的平均药物回收率达91%,不需要调整剂量。
(2)患者相关因素:ECMO支持的重症患者往往存在肺以外的器官功能不全,药物清除减少导致血药浓度升高。肾血流量减少或功能减退将导致肾小球滤过率下降,影响亲水性药物的消除,而肝脏功能降低则导致需要肝脏代谢的药物血药浓度增加。大量输液和毛细血管渗漏等也是导致Vd增加的因素。
(3)药物因素:药物的亲水性和PB,亲水性药物的Vd较低,其浓度受体液改变和大容量液体复苏的影响。亲脂性药物容易分布到组织中,Vd大,导致血药浓度低。由于重症患者血浆蛋白水平下降,PB 高的药物,其游离药物浓度显著增加。
(五)机械通气
机械通气对抗菌药物PK/PD影响有限的研究结果表明,机械通气可通过直接作用和间接作用影响抗菌药物的PK/PD指数。
1. 机械通气对抗菌药物PK 的直接影响
(1)机械通气对全身给药抗菌药物在肺内分布的影响:若机械通气参数设置不当,出现机械通气相关性肺损伤,肺泡-毛细血管膜的通透性变大,增加抗菌药物在肺上皮表层的分布,可能影响抗菌药物的疗效与消除速度【6】。
(2)机械通气影响经气道雾化吸入给药的抗菌药物在肺内的沉积:经气道给药可提高抗菌药物在肺组织中的浓度,提高抗菌药物的效能,减少因血药浓度增加导致的肝肾毒性。雾化给药时药物输送效率决定抗菌药物在肺组织的沉积量,直接影响PK/PD指数。抗菌药物的输送效率受机械通气多种参数的影响【7】。①呼吸机模式:使用定量雾化吸入器(MDI)给药时,持续正压通气(CPAP)模式比控制呼吸的输送效率高30%。对于呼吸系统顺应性好及气道阻力低的患者,使用雾化器给药时容量控制通气模式的输送效率比压力控制通气模式高。②吸气流速:吸气流速越慢,药物在肺组织的沉积越多,吸气流速升高,湍流越明显,药物微粒间的碰撞增加,药物在肺组织的沉积减少,输送效率降低;体外模型研究结果表明,潮气量及吸气时间相同时,30L/min的恒定气流比峰流速为60L/min的减速气流的输送效率更高。③潮气量:潮气量与雾化药物的输送效率直接相关,潮气量越大,雾化药物在肺组织的沉积越多;潮气量过低,气流可能不足以将气雾剂从雾化器输送到患者肺部。偏流:偏流对雾化药物的输送效率也有一定影响,偏流从2L/min增加至5L/min,气流对雾化药物的稀释增加,在2次呼吸之间更多的药物从呼出端洗脱,导致药物在肺组织的沉积下降。④雾化器在呼吸机管路中的位置:雾化器在呼吸机管路中的位置与药物微粒在呼吸机管路的沉积量密切相关,雾化器的最佳位置取决于雾化器的工作模式;持续雾化时,将雾化器置于距离“Y”形管一定距离的位置,可利用呼吸机送气管路的储气罐增加抗菌药物的输送效率;雾化与呼吸机送气同步时,雾化器距离患者越近,药物的输送效率越高。⑤湿化器:湿化气流将使雾化微粒吸附水分后直径变大,加速雾化微粒的沉积,增加药物在呼吸机管路及人工气道的沉积,减少下呼吸道药物沉积,降低输送效率;热湿交换器则完全阻断了气雾剂的输送,雾化时应移除。
2. 机械通气对抗菌药物PK的间接影响 机械通气主要通过影响血流动力学对抗菌药物的Vd及消除产生间接影响。采用间歇指令通气或压力释放通气等促进自主呼吸的模式对脏器功能的影响较小。正压通气和PEEP对脏器功能的影响较大,可导致心输出量减少,肝肾的灌注降低。胸内压升高使肺血管阻力增加,右心后负荷增大,影响右心室功能,使静脉回流受阻,导致内脏淤血;机械通气还能使腹内压升高,影响静脉回流,引起腹腔脏器淤血,上述机制均可导致肝肾及胃肠道血流减少,功能受损,从而影响药物的吸收及消除。此外,正压通气和PEEP可激活肾素-血管紧张素-醛固酮系统,抗利尿激素释放增加,心房钠尿肽分泌减少,导致肾脏灌注和肾小球滤过率(GFR)降低,钠排泄和尿量减少,导致水钠潴留,影响药物的Vd。
3. 机械通气患者经静脉应用水溶性抗菌药物时应考虑机械通气对Vd的影响 适当增加剂量,必要时应用负荷剂量。机械通气患者雾化抗菌药物治疗时,应尽量采用有利于药物在肺部沉积且减少药物损失的通气模式及参数。
(六)免疫治疗对于PK/PD的影响
在应用抗菌药物治疗病原微生物感染的过程中,必须充分认识人体免疫功能的重要性,过分依赖抗菌药物的作用而忽视人体内在因素常常是抗菌药物治疗失败的重要原因之一。例如,标准剂量两性霉素B脂质体(L-AMB)治疗非粒缺患者(免疫功能相对正常)具有足够的疗效,但烟曲霉MIC值为0.5~1mg/L 的粒缺患者(免疫功能低下)则需更高剂量才能够保证达到所需的PK/PD靶值,从而保证良好的临床疗效。免疫抑制状态(程度和时间长度)也会影响抗感染治疗的疗程。因此在应用抗菌药物的同时,必须尽最大努力改善人体全身状况和免疫状态,采用综合性措施如纠正水、电解质和酸碱平衡,改善微循环,补充血容量,纠正低蛋白血症、缓解基础疾病和控制局部病灶等,同样是非常重要的,均不可忽视。
三、重症患者根据PK/PD变化调整抗菌药物的关注点及建议
重症感染患者药物选择的关键点在于把抗菌药物的PK/PD属性合理结合到感染程度、感染类型、疾病类型、致病菌种类等因素中制定出符合个体化的给药方案。同时,重症患者需要常规监测并评估器官功能,评估器官功能支持手段对抗菌药物分布、代谢和清除的影响,及时调整给药途径、方式、剂量和频次。
(一)不同PK/PD属性抗菌药物的调整
1. 时间依赖性药物 感染严重程度不同对抗菌药物PK/PD靶值的要求不同,如轻中症感染,β-内酰胺类药物%T>MIC超过60%即可获得良好的疗效。重症感染为了获得最佳的疗效,%T>MIC可能需要达到100%,甚至需要超过4~5倍MIC(%T>4~5×MIC)。尽可能增加%T>MIC是对时间依赖性药物优化给药的关键:通过增加给药剂量、延长输注时间提高给药频率是常见的调整方式,以期获得杀菌率及杀菌范围最大化、抗菌药物耐药及药物毒性最小化。
(1)增加给药剂量:为了减少药物Vd对治疗效果的影响,特别是亲脂性药物,有研究表明大剂量给药能获得更高的血药浓度和%T>MIC。在脓毒症或脓毒性休克患者中可能需要高负荷剂量的碳青霉烯类,并且根据病原菌MIC以保证初始和维持的剂量调整【8】。
(2)提高给药频率:重度感染为了获得最佳的疗效可通过增加每日给药频率达到%T>4~5×MIC;有些时间依赖性药物由于自身的半衰期、PAE、蛋白结合率等原因,往往只需每日1次给药即可,例如:头孢曲松、厄他培南,但头孢曲松在重症感染时可以增加至每日2次给药。
(3)延长输注时间:美国胸科学会(ATS)/美国感染性疾病学会(IDSA)的指南中强调了通过延长碳青霉烯类药物的输注时间来经验性治疗医院获得性肺炎(HAP)以及可疑的呼吸机相关性肺炎(VAP)【9】。增加给药剂量同时联合延长输注时间可改善%T>MIC的达标比例,改善临床疗效,减少不良反应。
同时,在重症患者治疗中,还要考虑抗菌药物足够的治疗疗程。脓毒症指南中建议第2类碳青霉烯类抗菌药物经验性治疗脓毒症疗程需7~10天。
2. 浓度依赖性药物
(1)增加单次给药剂量:使用亲水性抗菌药物治疗有细胞外液明显增加的重症感染者时,由于Vd增加,给药后血药浓度峰值下降,通常需要在安全剂量内增加浓度依赖型抗菌药物的单次使用的剂量。
(2)延长给药间隔:对有耐药风险的严重感染病人,在安全剂量内可以提高药品单次使用的剂量,以提高血药峰浓度,但为了减少不良反应等考虑,可以适当的延长给药时间间隔,TDM的重要性也在此可以体现。
(3)对于浓度依赖性的药物,优化评价标准为Cmax/MIC值达到更高的水平,以达到最大的杀菌作用。需要注意的是,氨基糖苷类每日1次的给药方案并非适用于所有感染患者,在治疗感染性心内膜炎等重症感染时,仍需每日多剂量给药,在动物试验中已证实氨基糖苷类治疗肠球菌心内膜炎时,针对赘生物中活菌数的减少,每日多剂量给药优于每日单剂量给药【2】。
3. 时间-浓度依赖性药物 以达到更理想的Cmax/MIC和AUC0-24/MIC为目标调整抗菌药物的剂量及给药频次。
4. 优化给药方案的建议
(1)不需要调整给药剂量:
1)与药物特性相关:亲脂性、Vd较大的药物,重症感染或感染性休克时Vd变化不显著,一般也不需要调整初次给药剂量。低PB的抗菌药物(PB<30%)在感染、低蛋白血症时的分布和代谢受影响较小,一般不需要调整给药剂量及策略。亲水性药物,由于组织分布仅限于细胞外间隙,并且经肾脏清除,需增加起始剂量。
2)与药物代谢途径有关:患者功能障碍器官不影响药物代谢或清除途径时,药物剂量不需要调整。如肾功能障碍患者使用主要经肝脏代谢的药物,一般不需要调整剂量。
3)与药物代谢和清除器官的功能状态有关:器官功能障碍越严重对药物的代谢和清除影响越大,如伏立康唑主要经过肝脏代谢,轻度肝功能障碍时伏立康唑的给药剂量不需要调整,但中重度肝功能需要调整。
(2)负荷剂量和维持剂量:重症感染或感染性休克时亲水性药物的Vd增加明显,需要增加负荷剂量;而亲脂性药物在重症感染或感染性休克时Vd变化并不显著,不建议改变负荷剂量。估算给药维持剂量时,先计算总体清除率[总体清除率=肾脏清除率(CCr)+CRRT清除率(CRRT治疗剂量)],若为时间依赖性抗菌药物则计算清除率(清除率=目标血药浓度×总体清除率)及24h给药总剂量;若为浓度依赖性抗菌药物,则计算清除半衰期(清除半衰期=0.693×总体清除率/Vd和给药间隔。抗菌药物给药达到稳态后监测血药浓度,根据PK/PD目标调整临床给药方案。ICU内病原体对抗菌药物的敏感性下降,需增加剂量以达到PK/PD目标值。
(3)优化给药途径:抗菌药物在不同组织的穿透能力不同,在选择抗菌药物时应充分考虑药物在责任病灶的穿透能力,针对不同感染部位使用抗菌药物的目标血药浓度及PK/PD靶值也不同,如替加环素在胆道、结肠的浓度较高,治疗复杂腹腔感染时PK/PD的靶值为AUC0-24/MIC>6.96,但替加环素在皮肤软组织中的浓度是血浓度的60%,治疗皮肤软组织感染时替加环素的AUC0-24/MIC靶值则需要>18。
1)全身用药:①口服:用于轻中度感染的治疗,在此不过多描述。②肌注:中度感染可采用肌注给药,肌注后Cmax一般于0.5~1h到达。肌注给药有局部刺激,易在肌注部位形成硬结。③静脉推注和静脉滴注:为治疗中重度感染的常用给药方案。氨基糖苷类和多黏菌素类等每次静滴时间不宜少于1h,以免产生对神经肌肉接头的阻滞作用。氟喹诺酮类和碳青霉烯类每次静滴时间不宜少于1~2h,以减少中枢神经系统的不良反应。氟喹诺酮类如左氧氟沙星、环丙沙星等静脉制剂引起静脉炎较多见,静脉滴注时间也宜在1h以上。两性霉素B脱氧胆酸盐滴注的药液浓度不可超过10mg/100ml,每次滴注前先用注射用水溶解,再以5%葡萄糖液稀释;每次滴注时间为6h以上,以减少输注反应及心律失常等不良反应的发生率。
2)局部用药:抗菌药物的局部应用途径包括鞘内注射、气溶吸入、滴眼、滴鼻、皮肤和黏膜应用。局部用药需注意:选用能杀灭或抑制局部细菌而毒性较小的抗菌药物;选用的药物应没有或有极低的刺激性,以免损伤局部组织;药物应不易使人体发生过敏反应;用于大面积烧伤或创伤时,要注意抗菌药物因创面吸收过多而发生不良反应的可能。
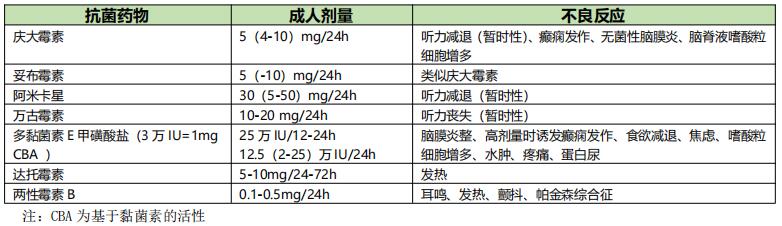
在治疗重症感染时,局部用药往往是静脉给药的辅助手段。例如治疗多重耐药菌引起的脑膜炎,可在全身给药的同时辅以局部用药,如万古霉素20mg 每日1次,脑室给药;两性霉素B静脉给药时脑脊液浓度极低,但鞘内给药时AUCCSF/AUCS可至100%。有研究证明两性霉素B鞘内给药的病死率明显低于非鞘内注射,而多黏菌素鞘内治疗成功率为89%【10】。氨基糖苷类(庆大霉素、妥布霉素、阿米卡星等)的每次鞘内注入量(成人)不宜超过10mg,一般以5mg为宜;两性霉素B宜从小剂量0.05mg开始,渐增至每次不超过1mg(成人剂量)为止(表5)。
表5 抗菌药物脑室内给药的推荐剂量及不良反应【1】
当肺部感染是由广泛耐药或全耐药的铜绿假单胞菌、鲍曼不动杆菌或肺炎克雷伯菌等所致时,可在全身抗菌治疗的基础上联合雾化吸入治疗,以增加肺组织局部浓度,提高疗效。雾化吸入的抗菌药物多选择黏膜不吸收,且局部组织浓度高的药物,目前采用的药物主要有,氨基糖苷类(阿米卡星、妥布霉素)和多黏菌素类(如多黏菌素E甲磺酸盐)等。雾化吸入方案为:阿米卡星:400mg,每日2次,或25mg/kg,每日1次;妥布霉素:300mg,每日2次;多黏菌素E甲磺酸盐基质30~60mg,溶于3~4ml生理盐水中,每日2次。
(4)疗程:抗菌药物的疗程因感染类型的不同而异,一般宜用至体温降至正常、症状消退后72~96h,但某些感染需要较长的疗程。感染性心内膜炎的疗程宜为4~6周或以上;伤寒在热退尽后宜继续用药7~10d以上防止复发;血流感染宜用药至症状消失和迁移性病灶消除后1~2周,以彻底清除病原菌;布鲁菌病易复发,四环素类(与氨基糖苷类联用)的疗程为6周或以上,有的患者需要用多个疗程方能治愈;青霉素治疗溶血性链球菌咽炎或扁桃体炎的疗程不宜少于10d,以彻底清除咽部的致病菌,防止或减少风湿热的发生;细菌性脑膜炎的疗程与病原菌种类有关,流感嗜血杆菌、脑膜炎球菌性脑膜炎的疗程为1周,李斯特菌脑、B组链球菌和革兰阴性菌脑膜炎的疗程为2~3周,免疫缺陷患者所需疗程更长;肺炎链球菌肺炎的疗程为体温降至正常后3~5d,而肠杆菌目细菌、铜绿假单胞菌或葡萄球菌肺炎的疗程应适当延长,军团菌、衣原体、支原体肺炎的疗程为2~3周;泌尿生殖道感染的疗程与部位有关,急性膀胱炎的疗程为3d,反复发作性尿路感染经14d抗菌治疗后还需维持治疗4~6周,急性肾盂肾炎的疗程一般为2周。抗菌药物治疗各类感染应随访疗效,多数急性感染抗菌药物使用48~72h后疗效不佳,需考虑调整用药【2】。
(二)重症患者器官功能减退时抗菌药物的调整
1. 重症患者肾功能减退时抗菌药物的应用 许多抗菌药物主要经肾脏排泄,某些品种有肾毒性,肾功能减退者应用该类药物时易发生不良反应。因此,治疗肾功能减退的感染患者时,应根据需要调整给药方案。
(1)抗菌药物应用于肾功能减退患者时,其剂量的调整需根据以下因素:肾功能损害程度;抗菌药物的肾毒性大小;药物的体内过程,即药代动力学特点;抗菌药物经血液或腹膜透析后可清除的程度。主要经肾排泄的药物,其血T1/2可因肾功能减退而延长。因此,血T1/2可作为调整用药的重要依据。由于个体差异的存在,不同患者的血T1/2相差甚大。因此,对于一些治疗浓度范围狭窄、毒性大的抗菌药物应进行血药浓度监测,并据此拟定个体化给药方案。根据抗菌药物的体内代谢过程和排泄途径,以及对肾脏和其他重要脏器的毒性大小,在肾功能减退时,药物的选用有以下4种情况。
1)用原治疗量或剂量略减:主要包括由肝脏代谢或主要自肝胆系统排泄的红霉素和阿奇霉素等大环内酯类、青霉素类,以及头孢菌素类的部分品种,如氨苄西林、头孢哌酮、抗真菌药物和抗分枝杆菌药物的多数品种。
2)可选用但剂量需适当减少者:该类药物无明显肾毒性或仅有轻度肾毒性,但由于其排泄途径主要经肾脏,肾功能减退时药物可在体内明显积聚,血T1/2显著延长。青霉素类和头孢菌素类的多数品种,如羧芐西林、青霉素、头孢他啶等均属该类药物。氟喹诺酮类中的氧氟沙星和左氧氟沙星亦属该类。
3)确有应用指征时在TDM下减量应用:该类药物均有明显肾毒性,且主要经肾排泄。氨基糖苷类、万古霉素和多黏菌素类等均属该类药物。
4)肾功能减退时不宜应用者:包括四环素类(多西环素除外)、呋喃类和萘啶酸等。
上述4类药物中,除第1类的多数品种和第4类外,其余在肾功能减退时均需调整给药剂量。肾功减退程度是调整剂量的重要指标。肾功能试验中,以内生肌酐消除率(endogenous creatinine clearance,Ccr)最具参考价值。肌酐几乎全部经肾小球滤过排泄,其排出量的最不受饮食、蛋白分解等因素的影响。Ccr 与肾小球滤过率(glomerular filtraion rate, GFR)基本上呈平行关系,可以定量、准确地反映患者的肾功能状态。
肾功能减退时给药方案的调整可以减少给药剂量或延长给药间期。前者为给药间期不变,每次给药量减少;后者为每次给药量不变,而给药间期延长。后一调整剂量的方法常使血药浓度波动幅度增大,可能影响对严重感染的疗效。因此,以应用减量法更为适宜,也可将两种调整方法结合应用。无论应用上述方法中的哪种,首次负荷量仍应按正常治疗量给于。
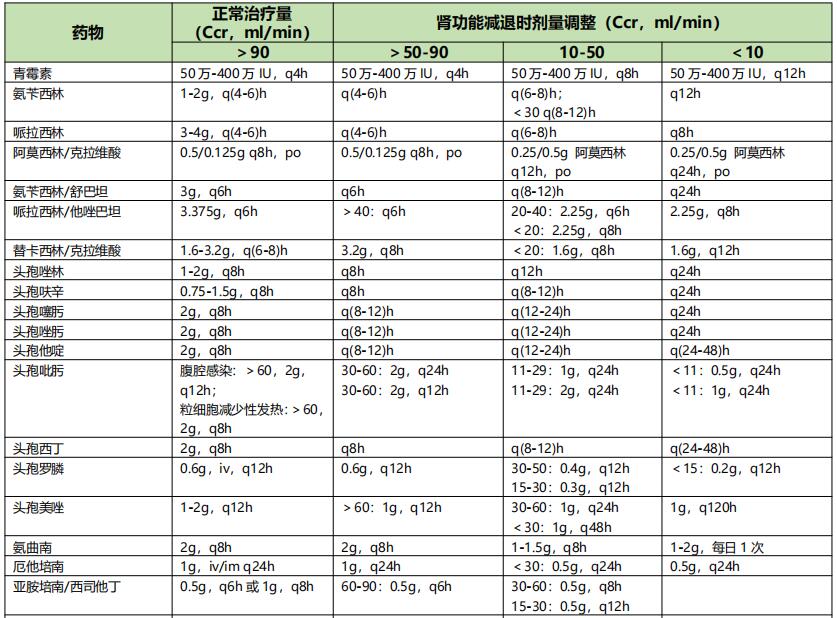
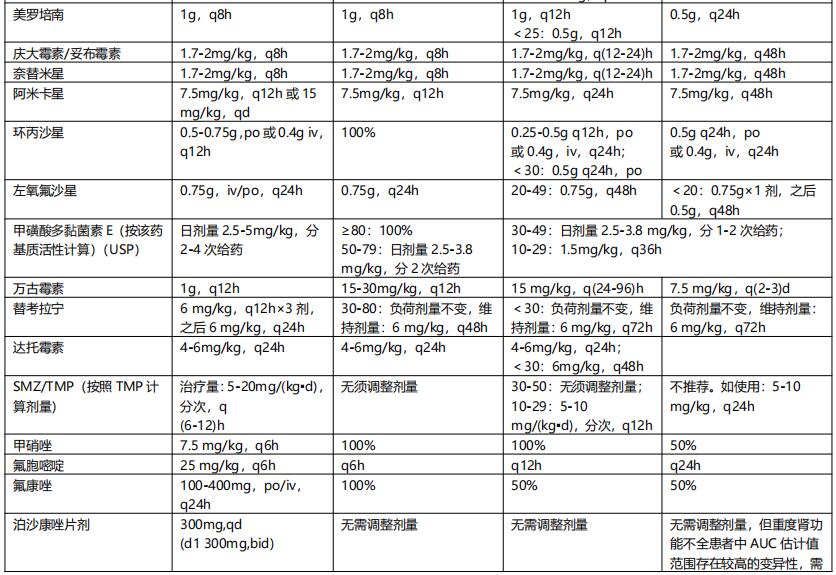
根据肾功能损害程度调整给药方案:依据Ccr值的改变,肾功能损害分为轻度、中度和重度损害,Ccr分别为>50~90 ml/min,10~50ml/min,<10ml/min。根据肾功能损害程度调整剂量详见表6。
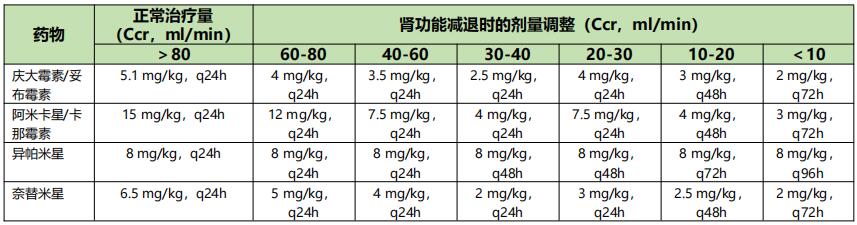
表6 重症感染伴肾功能减退时常见抗菌药物的剂量调整【2】
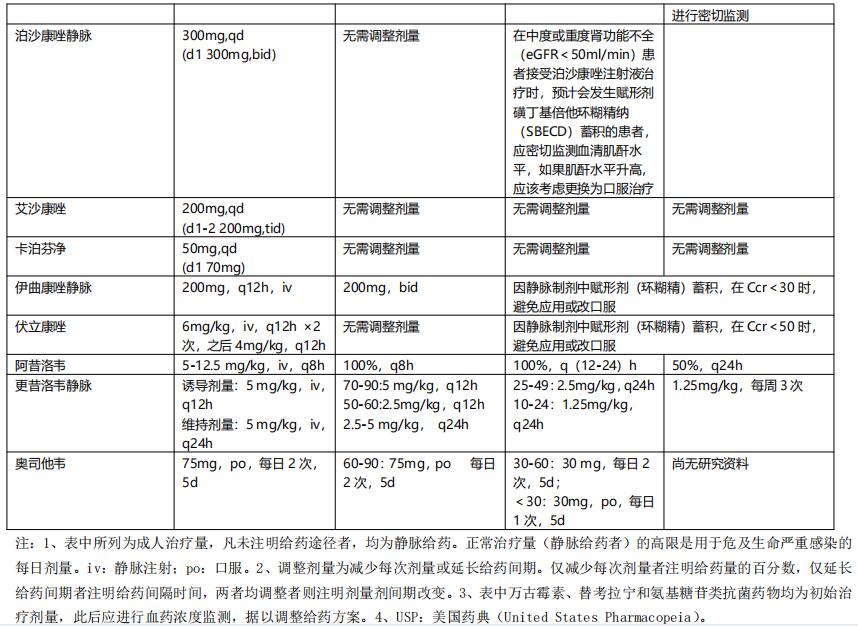
如缺少Ccr数值时,也可根据血肌酐值,按下式计算【2】。
(1)标准体重者:①男性:50.0kg+2.3kg×[(身高(cm)-152.4)÷2.54];②女性:45kg+2.3kg×[(身高(cm)-152.4)÷2.54]。
肥胖定义:实际体重超过20%标准体重,或体质指数>30kg/m2。
(2)非肥胖患者:
1)Ccr(男)(ml/min)=
2)Ccr(女)=Ccr(男)×0.85
(3)肥胖患者:
1)Ccr(肥胖男性患者)(ml/min)=
2)Ccr(肥胖女性患者)(ml/min)=
根据上述公式计算Ccr时需要注意以下几点:老年人由于肌肉组织减少,血肌酐值可能会假性减低,从而有药物剂量过大的危险;孕妇、腹腔积液患者及其他原因导致体液增加者,GFR增高,按常规给药时药物剂量可能偏小;产妇的体重应按照未怀孕时的标准体重计算。上述公式仅适用于估计常态下的肾功能情况,对于无尿或少尿患者可假定Ccr为5~8ml/min;计算氨基糖苷类药物给药剂量时,肥胖患者体重也可按以下公式调整:理想体重+0.4×(实际体重-理想体重);计算万古霉素给药剂量时,无论肥胖还是非肥胖患者均可采用实际体重(表7)。
表7 氨基糖苷类每日1次给药法:肾功能减退者的剂量调整【2】
脓毒症抗菌药物需根据抗菌药物亲水性与否进行调整(图9):初始剂量:在严重脓毒症早期使用亲水性抗菌药物时,Vd及药物清除率可能增大,需要给予足够的初始负荷剂量,尤其在最初的24~48h;脓毒症时,疏水性抗菌药物的Vd变化对药物浓度影响不大,可根据肾脏功能进行调节。维持剂量:在治疗过程中可根据患者的肾功能进行维持剂量的调整。
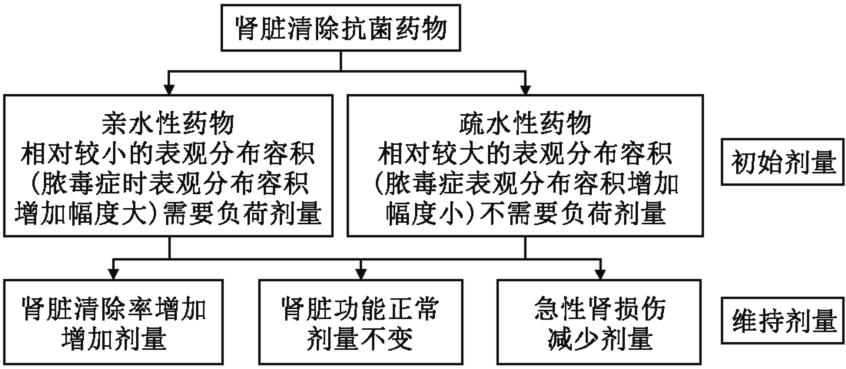
图9 抗菌药物亲水与否及肾功能障碍程度对抗菌药物剂量调整的影响
2. 重症患者肝功能减退时抗菌药物的应用
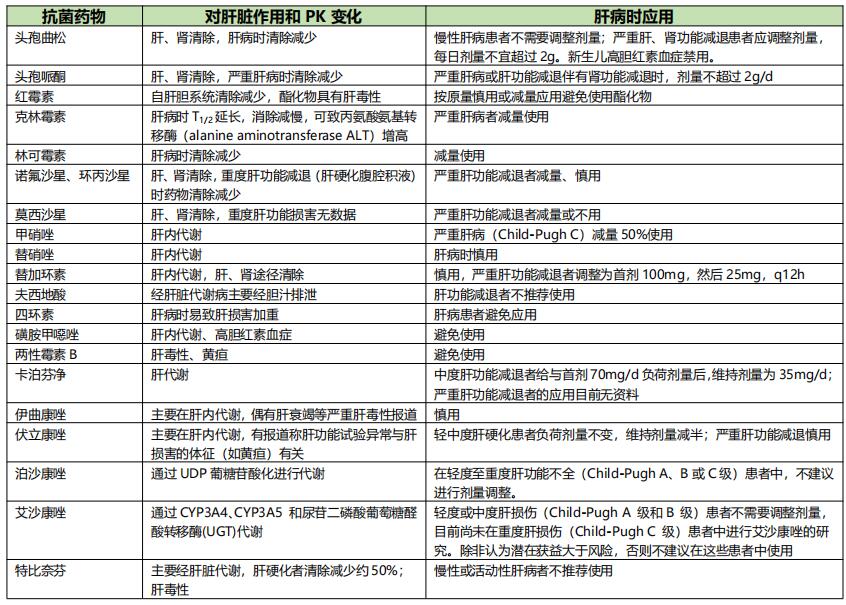
(1)调整抗菌药物的依据:目前常用的肝功能试验并不能反映肝脏对药物的代谢清除能力,因此,不能作为调整给药方案的依据。肝病时抗菌药物的选用及其给药方案的制订可参考肝功能减退对该类药物的药代动力学影响、肝病时该类药物发生毒性反应的可能性。大致可將肝病时抗菌药物的应用分为以下几种情况:
1)药物主要由肝脏清除:肝功能减退时,清除明显减少,但并无明显的毒性反应发生。故肝病患者仍可应用,但需谨慎,必要时减量给药。该类药物有红霉素等大环内酯类(不包括红霉素酯化物)、林可霉素和克林霉素等。
2)药物主要经肝脏或有相当量经肝脏清除:肝功能减退时,药物的清除或代谢物的形成减少,可能导致毒性反应发生。该类药物在肝病时宜避免应用,主要有氯霉素、利福平、红霉素酯化物、氨苄西林酯化物、磺胺药和咪康唑等。
3)药物经肝、肾途径清除:肝功能减退时,血药浓度升高。如同时有肾功能损害时,则血药浓度升高尤为明显。严重肝病时应减量应用。
4)药物主要由肾排泄:肝功能减退时,无须调整剂量。氨基糖苷类(庆大霉素等)、青霉素、头孢唑林、万古霉素和多黏菌素E甲磺酸盐等均属于该类药物。
(2)重症患者肝功能不全给药方案的调整:急性肝损伤患者应尽量避免与慎用有肝毒性的抗菌药物,如大环内酯类、磺胺类、四环素类、多数抗真菌类药物。不经肝代谢的抗菌药物不需调整剂量,如氨基糖苷类和糖肽类药物等。建议以肝脏为主要清除途经的抗菌药物,可根据急性肝功能损伤Child-Pugh分级指导剂量的调整。急性肝功能损伤患者使用以肝脏为主要清除途径的抗菌药物时,建议用TDM指导剂量调整(表8)。
表8 重症感染伴肝功能减退时常见抗菌药物的应用【2】
3. 重症患者心功能不全抗菌药物的应用 避免与慎用有心脏毒性的抗菌药物:AHF及心源性休克患者几乎均患有器质性心脏病,多合并心律失常,合并用药较多,且部分患者合并肝肾功能不全,因此具有多个Q-T间期延长及TdP危险因素。AHF合并感染的患者抗菌药物治疗时建议:
(1)充分评估危险因素,包括合并用药、电解质紊乱、长Q-T间期家族史、肝肾功能、心电图等来权衡抗菌药物方案的风险及受益;
(2)使用易致心律失常的抗菌药物时应密切监测心电图及电解质浓度;
(3)控制抗菌药物的浓度和滴速;
(4)减少合并用药;
(5)当心电图校正Q-T间期>500ms,或较基线延长60ms以上时需警惕潜在危险,重新评估治疗方案,并监测心电图至恢复正常。
目前,AHF合并感染患者的抗菌药物PK/PD临床研究资料很少,仅限于重症医学领域的个别研究。对于心输出量降低的AHF患者,尤其是伴器官、外周组织低灌注者,抗菌药物清除率下降,药物谷浓度升高,可适当减少抗菌药物的剂量以避免药物蓄积导致的不良反应。具有多种清除代谢途径的药物,如头孢曲松和环丙沙星等,药物蓄积情况则相对较少,可不予调整。其次,AHF合并低蛋白血症及组织水肿时,亲水性抗菌药物的Vd增大,常规剂量难以达到有效血药浓度,应调整剂量,并应用首剂负荷量以尽快使血药浓度达到目标值。亲脂性抗菌药物本身Vd较大,低蛋白血症和渗液导致的Vd影响较小,无需调整。
AHF合并感染时PK/PD指数多变,血流动力学不稳定,多合并使用血管活性药物和利尿剂,以上多重因素同时影响抗菌药物的PK/PD,使药物清除率、半衰期等参数变化较大,因此抗菌药物给药方案应根据PK/PD的特点及病原菌药敏试验结果进行动态调整,尤其需对药物治疗窗较窄的药物进行TDM并调整方案。
综上所述,AHF和心源性休克患者的病理生理学特征可影响抗菌药物的PK/PD,且个体差异较大,认识其意义并根据不同种类抗菌药物的PK/PD特点,适当调整抗菌药物剂量和滴注方式,同时注意抗菌药物引发的不良反应,可获得良好疗效,提高安全性。但目前尚缺乏充足的循证医学依据,需开展相关研究。
(三)重症患者生命支持治疗时抗菌药物的调整
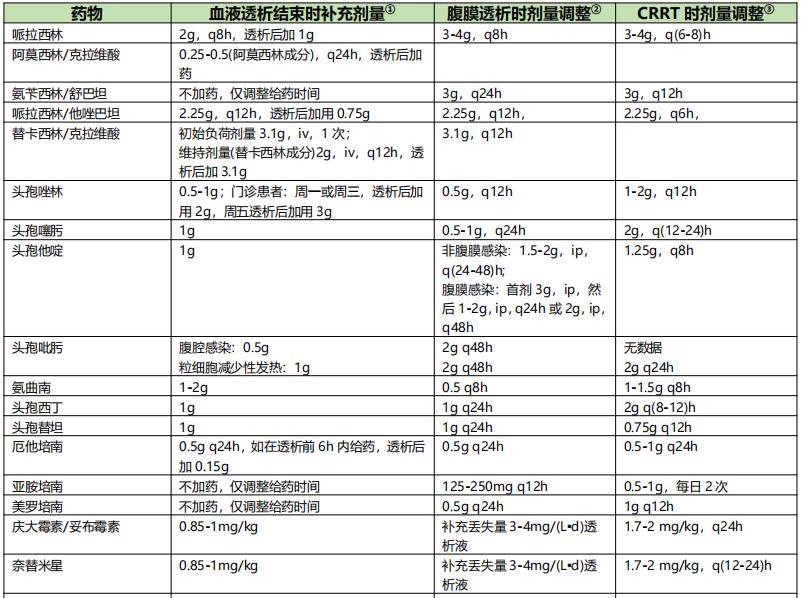
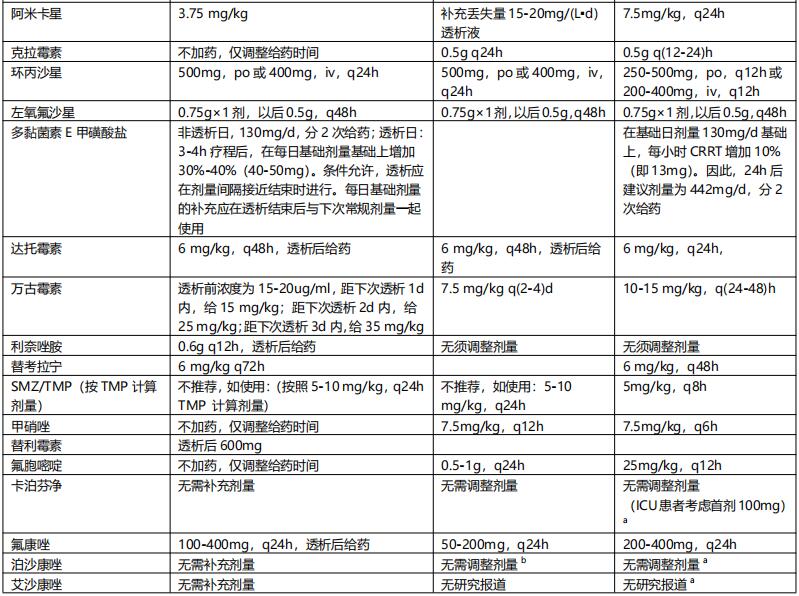
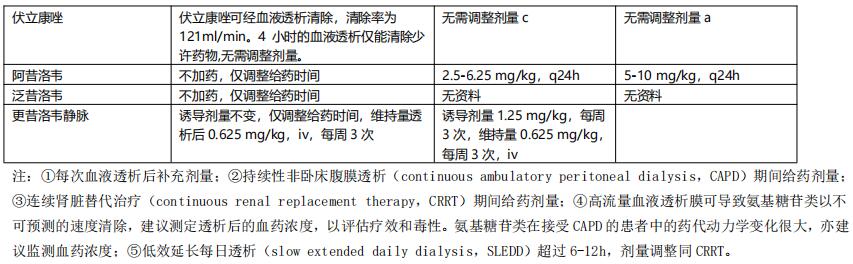
1. CRRT 重症感染行CRRT时影响抗菌药物清除的因素较多,药物剂量的调整应根据药物本身的PK/PD特性,并结合患者的器官功能状态、疾病严重程度及CRRT本身多种因素综合判断。个体化给药方案仍应建立在TDM的基础上。若暂时无法监测药物浓度,可依据残余肾功能与CRRT的清除率推算调整用药(表9)。
表9 透析治疗时抗菌药物的剂量调整【2】
2. 体外肝脏支持技术 对抗菌药物PK的影响表现在TPE及MARS均可增加抗菌药物的清除,TPE对低Vd和高PB的抗菌药物较容易清除,MARS则对高PB的抗菌药物清除增加,均可使某些抗菌药物浓度降低,影响抗感染效果。若在体外肝脏支持技术治疗期间(包括TPE、MARS)必须使用高PB或低Vd的抗菌药物时,治疗结束后,可根据情况增加剂量,建议治疗过程中进行TDM以指导抗菌药物的剂量调整。进行体外肝脏支持技术与抗菌药物使用时间不要太近,在TPE治疗期间尽量不要使用抗菌药物,避免抗菌药物迅速被清除;建议治疗过程中进行TDM,以指导抗菌药物剂量的调整(表8)。
3. ECMO 行ECMO治疗重症患者对抗菌药物PK/PD影响的因素较多,制定和调整抗菌药物给药方案时需根据病原菌及对药物的敏感性选择合适的药物,还应考虑每种药物的理化特性及ECMO对PK/PD的影响。
一般情况下,ECMO 中Vd增加,CL和消除量减少。通过与ECMO设备本身、药物特性、病理变化和患者特性的相互作用,药物PK会发生非常显著的变化。在成人和婴儿的研究中观察到的影响之间不存在一致的相关性。已有的文献已提示头孢曲松等高蛋白结合率以及伏立康唑等亲脂性抗菌药物在ECMO环路中丢失量大;但体外ECMO回路研究头孢曲松的药物回收率【11】显示,ECMO环路循环24h后药物回收率约80%,ECMO循环48h内保持稳定,仍建议常规剂量给药。在ECMO成人患者【12】中,万古霉素、哌拉西林/他唑巴坦、美罗培南、阿奇霉素、阿米卡星和卡泊芬净的PK无明显变化。而亚胺培南、奥司他韦、利福平、伏立康唑的药代动力学有明显变化。亚胺培南的谷浓度变化很大;奥司他韦CL降低,Vd增加,利福平浓度低于治疗水平,即使在ECMO患者使用高于标准剂量时也是如此。此外,伏立康唑在ECMO期间表现出较高的平均峰值浓度。由此建议成人患者应用ECMO时应调整亚胺培南、奥司他韦、利福平和伏立康唑的剂量,并在明确致病微生物进行目标性治疗的基础上,根据抗菌药物TDM结果进行调整。此外,感染灶的控制和引流、致病微生物的MIC及耐药性等也是影响ECMO患者抗菌药物疗效的重要因素,采用新材料和新技术可减少ECMO膜材和管路对抗菌药物的吸附,也是减少ECMO对抗菌药物PK影响的重要措施(表10)。
表10 重症感染患者ECMO 期间抗菌药物的应用【11】
4. 机械通气:经静脉应用水溶性抗菌药物时应考虑机械通气对Vd的影响,适当增加剂量,必要时用负荷剂量。雾化抗菌药物治疗时,尽量采用有利于药物在肺部沉积且减少药物损失的通气模式及参数。
5. 体外生命支持技术联合使用时的抗感染治疗药物应用 目前对体外生命支持联合使用时有关抗菌药物的PK/PD变化仅有少数文献报告。一篇论及机械通气联合CRRT治疗HAP和VAP时PK/PD优化策略时,作者指出对PK/PD的影响可归结为药物相关因素和感染相关因素两部分,药物因素如蛋白结合率决定了膜扩散,高蛋白结合的抗菌药物不太可能穿透血液-肺泡屏障;药物通过肺泡上皮细胞的程度也取决于药物的亲脂性和扩散性;感染因素如炎症程度和pH值,因为肺部感染会破坏肺泡壁,从而影响药物通过过程。因此常规给药方案往往导致治疗失败。根据这些因素建议亚胺培南/西司他丁/雷利巴坦调整剂量为500/500/250mg,q6h给药。同时也提出TDM可以最大限度地提高药物暴露的效力,同时最大限度地减少毒性,对PK不好定义的人群和耐药菌感染具有重要意义【13】。
有研究综述了最近发表的与烧伤患者接受CRRT和ECMO相关的抗菌药物药代动力学数据,认为这些群体的分布容积增加,需要使用更高的初始剂量来快速达到治疗性抗菌药物浓度,同时因为烧伤患者有异常的药物清除,需要更频繁地使用抗菌药物。但因为缺乏数据,即使存在终末器官衰竭,也未支持高于标准剂量治疗【14】。
抗真菌药物方面,卡泊芬净在ECMO治疗时的PK变化有争议,不过在一篇CRRT和ECMO同时应用的文献中卡泊芬净不需要进行药物剂量调整【15】;一例接受机械通气、CRRT和VV-ECMO的病例报道中,两性霉素B脂质体会被吸附,而换成两性霉素B脱氧胆碱盐则能测到浓度【16】。
人工肝的联合治疗涉及抗菌药物方面并没有相关文献提及。
6. 根据血药浓度监测结果制定个体化给药方案 重症感染患者本身因为病理改变导致其药代动力学变化巨大,同时由于各种支持治疗交替、联合使用后,患者的血药浓度监测无疑是指导临床用药调整很重要的依据,特别是在一些耐药菌感染的治疗当中。青霉素类、头孢菌素类、大环内酯类等由于其毒性低,治疗浓度范围宽,一般在治疗剂量范围内根据病情调整剂量,即可达到有效浓度水平,不易发生毒性反应。因此,原则上对上述抗菌药物,无须将TDM列为常规。但在特殊情况下,如肾功能减退患者发生严重感染需大剂量应用青霉素时,为防止脑脊液药物浓度过高而发生中枢神经系统毒性反应,则可进行脑脊液及血药浓度测定,以调整给药剂量。
最简单的根据药物浓度制定个体化给药方案为:峰-谷浓度法。以庆大霉素为例,如测定峰浓度过高,即可减少每日给药总量;如谷浓度过高,则可延长给药间期。随着检测技术的进步,相信TDM会逐渐普及并发挥指导抗菌药物的合理应用的重要方法。
致谢:狄佳女士在本节写作过程中对文献检索与核对、图表制作与核对给予了极大地帮助,在此一并致谢。
参考文献
【1】中国医药教育协会感染疾病专业委员会. 抗菌药物药代动力学/药效学理论临床应用专家共识[J]. 中华结核和呼吸杂志, 2018, 41(6):38.
【2】王明贵. 感染性疾病与抗微生物治疗[M].4 版.上海: 复旦大学出版社,2020.8.
【3】余毅、黄继义、叶朝阳. 血液净化在非肾脏疾病的临床实践[M].1版.北京:河南科学技术出版社,2020.
【4】Tisdale JE. Drug-induced QT interval prolongation and torsades depointes: role of the pharmacist in risk assessment, prevention and management [J]. Can Pharm J (Ott), 2016, 149 (3): 139-152. DOI:10. 1177/1715163516641136.
【5】Dzierba AL, Abrams D, Brodie D. Medicating patients during extracorporeal membrane oxygenation: the evidence is building [J].Crit Care, 2017, 21(1): 66. DOI:10.1186/ s13054-017-1644-y.
【6】Rello J, Rouby JJ, Sole-Lleonart C, et al. Key considerations on nebulization of antimicrobial agents to mechanically ventilated patients [J]. Clin Microbiol Infect, 2017, 23(9): 640-646.DOI:10. 1016/ j. cmi. 2017. 03. 018.
【7】Husain-Syed F, Slutsky AS, Ronco C. Lung-Kidney Cross-Talk in the Critically Ill Patient [J]. Am J Respir Crit Care Med, 2016,194(4): 402-414. DOI:10.1164/ rccm.201602-0420CP.
【8】Huang Y, Xu K, Zhan Y, Zha X, Liu S, Xie J, Liu L, Li Q, Shao H, Yang Y. Comparable Effect of Two-Step Versus Extended Infusions on the Pharmacokinetics of Imipenem in Patients with Sepsis and Septic Shock. Adv Ther. 2020 May;37(5):2246-2255. doi: 10.1007/s12325-020-01339-5. Epub 2020 Apr 10. PMID: 32277344; PMCID: PMC7223128..
【9】Kalil AC, Metersky ML, Klompas M, Muscedere J, Sweeney DA, Palmer LB, Napolitano LM, O'Grady NP, Bartlett JG, Carratalà J, El Solh AA, Ewig S, Fey PD, File TM Jr, Restrepo MI, Roberts JA, Waterer GW, Cruse P, Knight SL, Brozek JL. Management of Adults With Hospital-acquired and Ventilator-associated Pneumonia: 2016 Clinical Practice Guidelines by the Infectious Diseases Society of America and the American Thoracic Society. Clin Infect Dis. 2016 Sep 1;63(5):e61-e111. doi: 10.1093/cid/ciw353. Epub 2016 Jul 14. Erratum in: Clin Infect Dis. 2017 May 1;64(9):1298. Erratum in: Clin Infect Dis. 2017 Oct 15;65(8):1435. Erratum in: Clin Infect Dis. 2017 Nov 29;65(12):2161. PMID: 27418577; PMCID: PMC4981759.
【10】Yuchong C,Fubin C,Jianghan C, et al.Cryptococcosis in China (1985 - 2010): review of cases from Chinese database [J].Mycopathologia.2012.173 (5-6): 329-335.
【11】张慧芳, 王瑞兰. 成人体外膜氧合辅助治疗对常用抗感染药物药动学影响[J]. 中国感染与化疗杂志, 2022, 22(5):8.
【12】Hahn J, Choi JH, Chang MJ. Pharmacokinetic changes of antibiotic, antiviral, antituberculosis and antifungal agents during extracorporeal membrane oxygenation in critically ill adult patients. J Clin Pharm Ther. 2017 Dec;42(6):661-671. doi: 10.1111/jcpt.12636. Epub 2017 Sep 25. PMID: 28948652.
【13】Abouelhassan YP, Nicolau D. Pharmacokinetic/Pharmacodynamic Optimization of Hospital-Acquired and Ventilator-Associated Pneumonia: Challenges and Strategies. Semin Respir Crit Care Med. 2022 Apr;43(2):175-182. doi: 10.1055/s-0041-1742105. Epub 2022 Jan 27. PMID: 35088402.
【14】Jamal JA, Economou CJ, Lipman J, Roberts JA. Improving antibiotic dosing in special situations in the ICU: burns, renal replacement therapy and extracorporeal membrane oxygenation. Curr Opin Crit Care. 2012 Oct;18(5):460-71. doi: 10.1097/MCC.0b013e32835685ad. PMID: 22820155.
【15】Borsuk-De Moor A, Sysiak-Sławecka J, Rypulak E, Borys M, Piwowarczyk P, Raszewski G, Onichimowski D, Czuczwar M, Wiczling P. Nonstationary Pharmacokinetics of Caspofungin in ICU Patients. Antimicrob Agents Chemother. 2020 Aug 20;64(9):e00345-20. doi: 10.1128/AAC.00345-20. PMID: 32601169; PMCID: PMC7449161.
Branick K, Taylor MJ, Trump MW, Wall GC. Apparent interference with extracorporeal membrane oxygenation by liposomal amphotericin B in a patient with disseminated blastomycosis receiving continuous renal replacement therapy. Am J Health Syst Pharm. 2019 May 17;76(11):810-813. doi: 10.1093/ajhp/zxz054. PMID: 30994894.
南京大学医学院附属金陵医院呼吸与危重症医学科
教授、主任医师、博士生导师、博士后导师
美国胸科医师学会资深会员
江苏省医学会呼吸病学分会第七、八届主任委员
中国医药教育学会感染疾病专业委员会常委
中国医药教育学会真菌病专业委员会常委
中国老年医学会呼吸病学分会常委兼感染学术委员会主任委员
中国药学会第三届药物临床评价研究专业委员会抗感染学组副组长
免责声明
版权所有©人民卫生出版社有限公司。 本内容由人民卫生出版社审定并提供,其观点并不反映优医迈或默沙东观点,此服务由优医迈与环球医学资讯授权共同提供。
如需转载,请前往用户反馈页面提交说明:https://www.uemeds.cn/personal/feedback
来源:人民卫生出版社《临床知识》约稿
作者:施毅,南京大学医学院附属金陵医院
编辑:环球医学资讯余霞霞






 Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
