张兰军 张汝思
中山大学肿瘤医院
摘要
可手术切除肺癌患者即使接受了临床指南推荐的根治性手术切除及辅助治疗后,仍存在一定的复发风险,同时部分低复发风险的肺癌患者术后也有可能无需辅助治疗,从而无需承受辅助治疗相关的毒副作用。微小残留病灶(Minimal Residual Disease, MRD)的检测,具有解决这两大问题的巨大临床应用前景。目前,肺癌术后MRD检测主要围绕着提高复发预测的灵敏度和特异性,来设计并改进检测方法。同时已有不少研究表明,肺癌术后MRD预测复发有着不错的灵敏度和特异性,而且对于辅助治疗疗效的预测,也有初步证据表明是可行的。但是,MRD检测在肺癌术后患者中大范围推广,仍有一定的距离,本文将主要讲述目前常用的MRD检测方法以及MRD检测的临床应用证据,并提出MRD检测的瓶颈及未来研究的方向。
关键字:肺癌;复发;辅助治疗;微小残留病灶;循环肿瘤DNA;
前言
肺癌在全世界范围发病率占所有新发癌症发病率的11.4%,仅次于占比为11.7%的乳腺癌,而且肺癌相关死亡占所有癌症所致死亡的18%,为所有癌症之首[1]。根据美国国立综合癌症网络(NCCN)及中国临床肿瘤学会(CSCO)指南显示:早期肺癌及无多站纵隔淋巴结、对侧纵隔淋巴结或锁骨上淋巴结转移的中期肺癌(I-ШA)的主要治疗手段为根治性手术切除[2]。然而,相当一部分患者即使接受了手术治疗和相应的辅助治疗后,仍然出现肺癌复发的情况。有研究表明,94%的复发患者术后首次抽血,就能用循环肿瘤DNA(Circulating tumor DNA, ctDNA)检测到微小残留病灶(Minimal Residual Disease, MRD),这比影像学所能检测到复发的时间中位数提早了5.2个月[3]。这表明术后复发的主要危险因素为MRD,MRD检测具有预测术后复发的作用,从而能指示预后。另一方面,LACE(Lung Adjuvant Cisplatin Evaluation)荟萃分析及ADAURA、IMPOWER 010等研究(国际多中心III期RCT研究)均表明,术后辅助治疗,包括化疗、靶向治疗及免疫治疗,均能进一步提高肺癌患者的无病生存率[4–6]。但遗憾的是,上述研究均没有使用MRD检测进一步筛选最有可能从辅助治疗中获益的术后患者人群,因而使用MRD制定肺癌术后患者个性化辅助治疗,将会是未来研究的热点。本文将主要讲述目前常用的MRD检测方法以及MRD检测的临床应用证据,并提出MRD检测的瓶颈及未来研究的方向。
MRD检测方法
MRD通常是指根治性治疗后残留的微量癌细胞,此时影像学无法检测出可见的病灶,但是可以通过使用灵敏度较高的方法,从血液中检测残留癌细胞释放入血的ctDNA来检测MRD[7]。MRD最早用于血液肿瘤的疗效评估及复发监测,后来逐渐应用于实体肿瘤中。目前肺癌MRD最常用的检测方法是使用ctDNA的二代测序方法(Next Generation Sequencing, NGS),相比于治疗前或者晚期肺癌来说,根治性治疗术后外周血的ctDNA水平较低,故低水平突变等位基因频率(Variant allele frequency ,VAF)的检测需要更高的检测灵敏度。增加检测灵敏度的其中一个方法,为使用患者原发肿瘤的突变基因来制作个体化的ctDNA检测序列,进而能过滤非肿瘤突变,如意义未明的克隆性造血(Clonal Hematopoiesis of Indeterminate Potential, CHIP)相关的突变,并加强测序深度。因而,MRD的检测方法可根据是否需要原发肿瘤突变信息,分类为肿瘤知情(Tumor-informed assays)和肿瘤不知情(Tumor-naive assays)的MRD检测[8]。两者各有优缺点,一方面,肿瘤知情的MRD检测理论上能获得更高的灵敏度和特异性。另一方面,由于肿瘤知情的MRD检测需要原发肿瘤的测序信息,从而对部分无法获取原发肿瘤标本的患者存在使用的限制。而且肿瘤知情的MRD检测需要更长的检测时间及更高的费用,来对MRD检测进行个体化设计。此外,肿瘤知情的MRD检测的基因突变仅限于原发肿瘤的突变谱,存在部分在辅助治疗过程中新产生的耐药突变无法检测的情况,从而导致假阴性的结果。
亦有研究表明,提升MRD检测灵敏度的另外一个方向为提高测序的广度,因而有的MRD检测方法除了应用靶向NGS,还整合利用了全基因组测序(Whole Genome Sequencing, WGS)或全外显子测序(Whole Exome Sequencing, WES)[9]。另外,此方法还能更好地把基因组层面的拷贝数变异(Copy Number Alteration, CNA)整合到MRD的检测中,从而进一步提高MRD检测的灵敏度。
此外,由于根治性治疗后ctDNA VAF普遍较低,导致有限的血液抽取(常用10ml)中ctDNA样本量过低,因而ctDNA的富集方法也是MRD检测中的重要一环。目前MRD检测中ctDNA富集方法主要包括以聚合酶链式反应(Polymerase chain reaction,PCR)扩增为基础的多重PCR(Multiplexed PCR)和分子条码杂交捕获(Hybrid Capture with Molecular Barcoding)两种方法[8]。多重PCR所需的样本输入量较大,这是在根治性治疗后水平较低的ctDNA应用情景中的一个主要限制,但其准确性相对较高。另一方面,分子条码杂交捕获所需的样本输入量较小,但容易出现假阳性,但可以通过数据分析中的生信技术、队中血单核细胞中测序结果来过滤假阳性结果等一系列技术,来提高检测的准确性。
肺癌MRD临床应用证据
TRACERX研究率先使用肿瘤知情的个体化多重PCR来监测非小细胞肺癌(Non-small Cell Lung Cancer, NSCLC)患者术后MRD,研究共入选了24名IA-IIIB期NSCLC术后患者,其中14名术后复发患者中,有13名患者被检测出MRD阳性,灵敏度达94%,而且比影像学能检测到复发转移灶的中位时间提早了70天。然而,在另外无复发的10名术后患者中,有3名患者被检测出MRD阳性,因而特异性为70%,这是MRD在肺癌术后患者复发检测的临床推广前仍需提高的一个方面[10]。随后更新的TRACERX研究对MRD的检测技术做了相应的调整,同样也是以肿瘤知情的个体化多重PCR为基础,但是大大地提升了MRD检测的特异性,在23名无复发NSCLC术后患者的199份多个时间点的标本中仅有1份阳性,个体特异性达96%。另外在45名存在复发事件的NSCLC术后患者中,有37名患者MRD阳性,保持了较高的灵敏度(82%),同时把领先影像学发现复发转移病灶的中位时间提早到151天[11]。
DYNAMIC研究同样是以多重PCR来扩增ctDNA,但采取的是肿瘤不知情的MRD检测,以8个NSCLC常见突变的基因为靶标,包括EGFR、KRAS、ERBB2、PIK3CA、MET、TP53、ALK和RET,相比TRACERX肿瘤知情个体化的MRD检测,DYNAMIC研究MRD预测术后复发的灵敏度较低,仅为44%,而特异性为88%。另一方面,DYNAMIC研究进一步探索了MRD检测的时机,研究设定了多个MRD检测的时间点,包括术前、术中标本离题后5分钟、术中标本离题后30分钟、术中标本离题后2小时、术后第一天、术后第三天和术后第30天,研究表明,ctDNA的中位半衰期为35分钟,且术后MRD阳性患者的ctDNA半衰期显著较长。DYNAMIC研究还发现,术后第三天MRD阳性患者的无复发生存时间及总体生存时间均较第三天MRD阴性患者较短[12]。因而DYNAMIC研究表明,肺癌术后MRD检测是一个可行的预后预测工具,而且为术后MRD检测的最佳时机提供了参考的数据。
另外一项研究设计的MRD检测方法整合了靶向NGS与WGS,名为MRDetect。在22名I-III期NSCLC术后患者中,5名术后复发的患者均能检测出MRD阳性,17名无术后复发的患者中12名MRD阴性,故此小样本的MRDetect的灵敏度为100%,特异性为71%[9]。
国内不少研究对MRD在指导肺癌术后患者辅助治疗的作用,也做了非常有意义的探索(见表1),积累了大量真实世界研究的病例和临床经验。多项研究不仅表明MRD在预测中国NSCLC患者人群的术后复发风险中具有良好的灵敏度和特异性,还进一步表明肺癌术后辅助化疗获益人群主要为MRD阳性者,而MRD阴性人群术后辅助治疗获益不大[13–15],这为肺癌术后患者是否需要辅助化疗,提供了可行的个性化预测工具。另外,已有不少探索MRD对免疫检查点抑制剂疗效预测作用的III期随机对照临床研究正在进行中。其中MERMAID 1(NCT04385368)研究入选了II-III期NSCLC术后MRD阳性患者,并随机分配到辅助化疗联合免疫检查点抑制剂或辅助化疗联合安慰剂组,其主要结局为无病生存时间;MERMAID 2(NCT04642469)则是入选了完成根治性切除及辅助或新辅助化疗的II-III期NSCLC患者,所有患者均会接受术后长达2年的MRD监测,一旦出现MRD阳性,就会随机分配到免疫检查点抑制剂辅助治疗组或安慰剂辅助治疗组,其主要结局亦为无病生存时间。两个研究将进一步探索MRD对免疫检查点抑制剂术后辅助治疗的预测作用,并为肺癌患者提供免疫检查点抑制剂术后辅助治疗的个体化选择工具。
表1:肺癌术后MRD国内外研究汇总
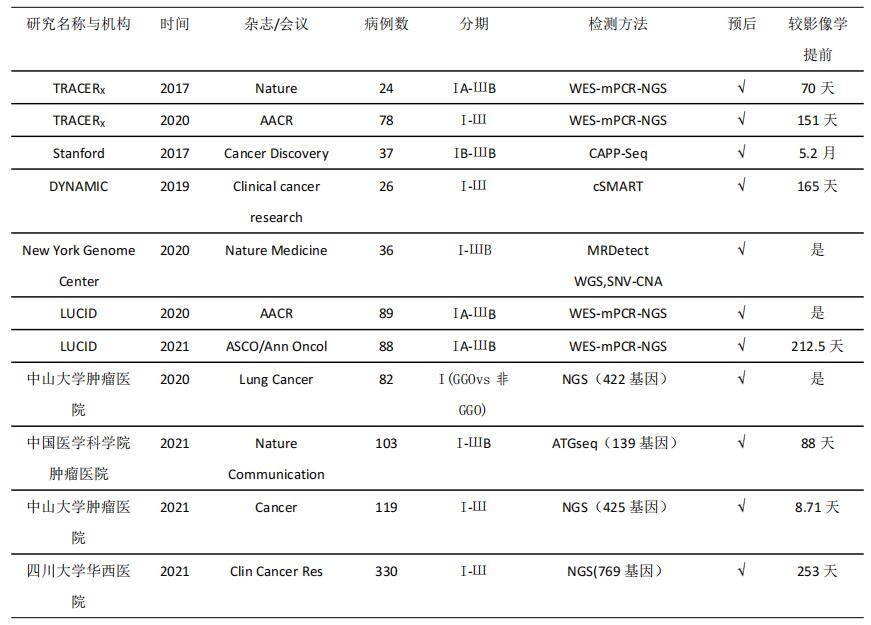
NCCN及CSCO指南对于不可切除无远处转移的NSCLC(IIIB-IIIC),目前推荐同期放化疗及后续辅助免疫治疗[2]。在同期放化疗后予以MRD监测复发,并及早提升治疗强度也是MRD检测的重要应用情景。一项研究设计了以分子条码杂交捕获为基础的NGS MRD检测方法,在37名IB-IIIB接受了同期放化疗NSCLC患者的MRD检测中,复发预测的灵敏度及特异性均可达到100%[3]。另外,亦有研究表明MRD检测能进一步用于区分同期放化疗后辅助使用免疫治疗的获益人群,从而个体化指导免疫辅助治疗,并避免部分人群不必要地承担用药风险[16]。
讨论
相当一部分肺癌患者,术后即使按临床指南规范地接受了辅助治疗,仍会出现复发;另一方面,部分肺癌患者术后复发风险较低,过度的辅助治疗不仅没有让此部分患者获益,反而增加了患者承受辅助治疗带来的相关毒副作用。因此,MRD的检测具有巨大的临床需求,一方面能及早发现复发高风险患者,进而及早干预治疗,争取治愈更多患者,减少复发,延长总体生存时间;另一方面则是甄别肺癌术后复发低风险者,避免过度治疗所导致的相关风险,给患者一个真正的无治疗假期(Drug Holiday)。目前已有不少研究设计了适用于肺癌术后患者的MRD检测方法,并证实具有不错的灵敏度和特异性,但MRD离临床推广仍有一定距离。
目前MRD检测的瓶颈主要包括两个方面:第一是灵敏度,由于肺癌术后患者ctDNA的VAF往往较低,因此MRD的检测必须有检测超低水平ctDNA的能力,目前主要的解决方法是结合原发肿瘤的突变谱来设计肿瘤知情的MRD检测以及ctDNA的有效富集技术。第二是特异性,肺癌术后患者MRD的检测往往会受到CHIP相关突变,包括TP53、KRAS等的干扰,如何分辨ctDNA的突变及CHIP相关突变,是提升MRD检测特异性的重要一环;另外,高灵敏度所导致的假阳性也是提高MRD检测特异性的其中一个方面。目前的主要解决方法为设计肿瘤知情的MRD检测,以及同时测量血液中单核细胞的CHIP,来过滤肿瘤无关突变信息的干扰。除了提高MRD检测对术后复发的灵敏度和特异性,未来MRD的检测仍需努力的方向还包括对不同术后辅助治疗疗效的预测效能,明确术后监测MRD的最优时间点以及进一步降低检测费用。
参考文献
[1] Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin 2021;71:209–49. https://doi.org/10.3322/caac.21660.
[2] National Comprehensive Cancer Network. Non-Small Cell Lung Cancer (Version 1. 2022). https://www.nccn.org/professionals/physician_gls/pdf/nscl.pdf. Accessed Feburary, 26, 2022. n.d.
[3] Chaudhuri AA, Chabon JJ, Lovejoy AF, Newman AM, Stehr H, Azad TD, et al. Early Detection of Molecular Residual Disease in Localized Lung Cancer by Circulating Tumor DNA Profiling. Cancer Discov 2017;7:1394–403. https://doi.org/10.1158/2159-8290.CD-17-0716.
[4] Pignon J-P, Tribodet H, Scagliotti GV, Douillard J-Y, Shepherd FA, Stephens RJ, et al. Lung Adjuvant Cisplatin Evaluation: A Pooled Analysis by the LACE Collaborative Group. JCO 2008;26:3552–9. https://doi.org/10.1200/JCO.2007.13.9030.
[5] Wu Y-L, Tsuboi M, He J, John T, Grohe C, Majem M, et al. Osimertinib in Resected EGFR-Mutated Non-Small-Cell Lung Cancer. N Engl J Med 2020;383:1711–23. https://doi.org/10.1056/NEJMoa2027071.
[6] Felip E, Altorki N, Zhou C, Csőszi T, Vynnychenko I, Goloborodko O, et al. Adjuvant atezolizumab after adjuvant chemotherapy in resected stage IB-IIIA non-small-cell lung cancer (IMpower010): a randomised, multicentre, open-label, phase 3 trial. Lancet 2021;398:1344–57. https://doi.org/10.1016/S0140-6736(21)02098-5.
[7] Shields MD, Chen K, Dutcher G, Patel I, Pellini B. Making the Rounds: Exploring the Role of Circulating Tumor DNA (ctDNA) in Non-Small Cell Lung Cancer. Int J Mol Sci 2022;23. https://doi.org/10.3390/ijms23169006.
[8] Chen K, Shields MD, Chauhan PS, Ramirez RJ, Harris PK, Reimers MA, et al. Commercial ctDNA Assays for Minimal Residual Disease Detection of Solid Tumors. Mol Diagn Ther 2021;25:757–74. https://doi.org/10.1007/s40291-021-00559-x.
[9] Zviran A, Schulman RC, Shah M, Hill STK, Deochand S, Khamnei CC, et al. Genome-wide cell-free DNA mutational integration enables ultra-sensitive cancer monitoring. Nat Med 2020;26:1114–24. https://doi.org/10.1038/s41591-020-0915-3.
[10] Abbosh C, Birkbak NJ, Wilson GA, Jamal-Hanjani M, Constantin T, Salari R, et al. Phylogenetic ctDNA analysis depicts early-stage lung cancer evolution. Nature 2017;545:446–51. https://doi.org/10.1038/nature22364.
[11] Abbosh C, Frankell A, Garnett A, Harrison T, Weichert M, Licon A, et al. Phylogenetic tracking and minimal residual disease detection using ctDNA in early-stage NSCLC: A lung TRACERx study. Cancer Research 2020;80:CT023. https://doi.org/10.1158/1538-7445.AM2020-CT023.
[12] Chen K, Zhao H, Shi Y, Yang F, Wang LT, Kang G, et al. Perioperative Dynamic Changes in Circulating Tumor DNA in Patients with Lung Cancer (DYNAMIC). Clin Cancer Res 2019;25:7058–67. https://doi.org/10.1158/1078-0432.CCR-19-1213.
[13] Zhang J-T, Liu S-Y, Gao W, Liu S-YM, Yan H-H, Ji L, et al. Longitudinal Undetectable Molecular Residual Disease Defines Potentially Cured Population in Localized Non-Small Cell Lung Cancer. Cancer Discov 2022;12:1690–701. https://doi.org/10.1158/2159-8290.CD-21-1486.
[14] Xia L, Mei J, Kang R, Deng S, Chen Y, Yang Y, et al. Perioperative ctDNA-Based Molecular Residual Disease Detection for Non-Small Cell Lung Cancer: A Prospective Multicenter Cohort Study (LUNGCA-1). Clin Cancer Res 2022;28:3308–17. https://doi.org/10.1158/1078-0432.CCR-21-3044.
[15] Qiu B, Guo W, Zhang F, Lv F, Ji Y, Peng Y, et al. Dynamic recurrence risk and adjuvant chemotherapy benefit prediction by ctDNA in resected NSCLC. Nat Commun 2021;12:6770. https://doi.org/10.1038/s41467-021-27022-z.
[16] Moding EJ, Liu Y, Nabet BY, Chabon JJ, Chaudhuri AA, Hui AB, et al. Circulating Tumor DNA Dynamics Predict Benefit from Consolidation Immunotherapy in Locally Advanced Non-Small Cell Lung Cancer. Nat Cancer 2020;1:176–83. https://doi.org/10.1038/s43018-019-0011-0.
[17] Hellmann MD, Nabet BY, Rizvi H, Chaudhuri AA, Wells DK, Dunphy MPS, et al. Circulating Tumor DNA Analysis to Assess Risk of Progression after Long-term Response to PD-(L)1 Blockade in NSCLC. Clin Cancer Res 2020;26:2849–58. https://doi.org/10.1158/1078-0432.CCR-19-3418.
教授、主任医师、博士及博士后导师
中山大学肿瘤医院胸科、科主任导师 、肺癌首席专家
中华医学会胸心血管外科分会委员兼肺癌外科学组 副组长
中国医师协会胸外科分会肺癌专家委员会 副主委
中国医师协会整合医学会胸外科分会 副主委中国抗癌协会科普专业委员会 常委
国家癌症中心肺癌质控专家委员会 委员
美国胸心外科学会(AATS)Active Member
欧洲胸外科学会(ESTS)Active Member
国际肺癌研究协会(IASLC) Active Member
国际罕见肿瘤协会(RCN)Active Member
中国抗癌协会肺癌专业委员会 委员
中国抗癌协会食管癌专业委员会 委员
中国医促会理事兼胸外科分会 副主委
中国医促会理事兼肺癌防控分会 副主委
中国临床肿瘤学会CSCO非小细胞肺癌专业委员会 常委
中国医学教育学会肺癌教育委员会 副主委
中国医学教育学会胸外科分会 副主委
海峡两岸医药卫生交流协会胸外科分会 副主委
世界华人肿瘤医师协会胸部肿瘤专业委员会 副主委
中国胸外科肺癌联盟CLCU南方联盟 主席
广东生物医学工程学会理事兼胸心外科分会 主委
广东临床医学学会资深专家委员会 副主委
第三届‘国之名医’ 优秀风范获得者(2019年)
‘羊城好医生’及‘岭南名医’获得者
广东省委医疗保健专家
免责声明
版权所有©人民卫生出版社有限公司。 本内容由人民卫生出版社审定并提供,其观点并不反映优医迈或默沙东观点,此服务由优医迈与环球医学资讯授权共同提供。
如需转载,请前往用户反馈页面提交说明:https://www.uemeds.cn/personal/feedback
来源:人民卫生出版社《临床知识》约稿
作者:张兰军,中山大学肿瘤医院;张汝思
编辑:环球医学资讯余霞霞








 Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.