59岁男性,因“颈前路减压植骨融合内固定术后11天,气促、发热3天”从骨科转入笔者科室。医生几番辛苦才找到“真凶”。
【病情介绍】
患者,男性,59岁。因“颈前路减压植骨融合内固定术后11天,气促、发热3天”从骨科转入笔者科室。患者于2011年1月27日在全麻下行颈前路减压植骨融合内固定术(C3~C7),术后予以抗感染、化痰、营养神经等治疗。术后患者恢复可,四肢肌力恢复良好。患者于1月30日下床活动。2月3日患者出现呼吸困难、气促,咳少量黏痰,怀疑为咽喉壁水肿所致,先后予以头孢曲松钠、头孢孟多酯钠抗感染,甲泼尼龙500mg抗炎治疗。2月5日出现发热,体温最高38.0℃,予以头孢曲松钠抗感染,地塞米松抗炎,复方氨基比林退热治疗。2月6日患者体温最高39℃,气促加剧,查血常规WBC 21.4×109/L,加左氧氟沙星抗感染,症状无好转,气促加剧,请笔者科室会诊后于2011年2月7日转入笔者科室。患者平素健康,否认高血压、糖尿病等病史,否认结核、肝炎等传染病病史,1999年行腰后路减压植骨融合内固定术,输血400ml,否认药物及食物过敏史。
体格检查:T 38.6℃,HR 153次/分,R 28次/分,BP 75/58mmHg。一般情况差,嗜睡状,双侧瞳孔等大,对光反射存在。双下肺呼吸音减低,可闻及痰鸣音。心率153次/分,律齐,各瓣膜听诊区未闻及杂音。腹膨隆,肝脾肋下未触及,肠鸣音正常,移动性浊音阴性。右侧颈部可见一长约10cm的手术瘢痕,无红肿,无压痛,无液波感。腰部和左侧髂前上棘可见陈旧性手术瘢痕。切口愈合良好。双上肢肌力2级,双下肢肌力1级。
辅助检查:心电图(1月26日):窦性心律。心脏彩超(1月26日):左心室收缩末内径30mm,射血分数64%,主动脉内径正常,房室各腔内径正常。室间隔与左心室后壁厚度正常,运动呈逆向,静息状态下未见明显节段性室壁运动异常。肺功能(1月26日):通气功能基本正常;残总百分比正常;弥散功能正常;气道阻力增高。
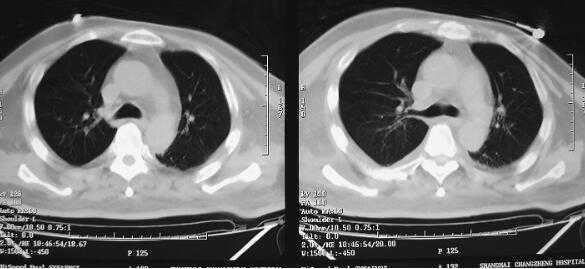
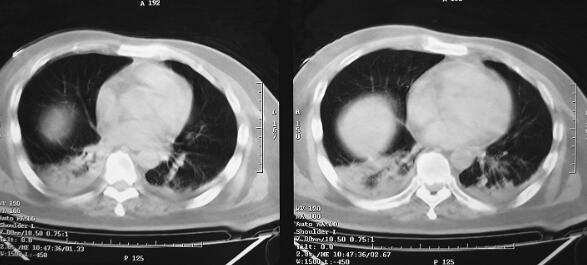
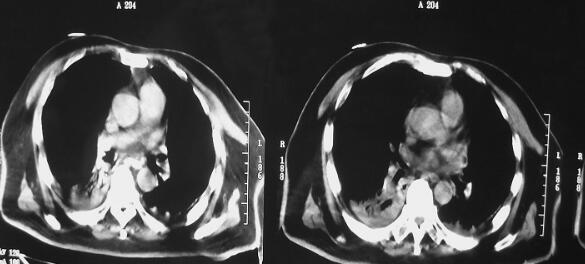
图1 CT(2月7日)结果:双下肺肺不张,双侧胸腔积液
诊治经过:患者入笔者科室后一般情况较差,血压测不出,氧饱和度84%,予以羟乙基淀粉扩容,多巴胺、去甲肾上腺素微泵维持血压,碳酸氢钠纠正酸中毒。立即予以气管插管,呼吸机辅助通气。完善相关检查:CT(图1)结果:①头颅CT平扫未见明显异常;②双下肺肺不张;③双侧胸腔积液;④肝右叶钙化灶。血常规(2月7日):WBC 20.9×109/L,N 94%。心脏彩超(2月8日):左心室舒张末内径61mm,射血分数38%。胸片(图2~图4)诊断:①双侧肺炎;②颈椎术后。先后给予头孢曲松钠和左氧氟沙星、美罗培南和替考拉宁抗感染。因痰培养鲍曼不动杆菌(2月10日),对头孢哌酮-舒巴坦钠敏感,余均耐药,故停用美罗培南,改用头孢哌酮-舒巴坦钠。多次血培养结果提示白念珠菌(2月6日、2月7日、2月9日、2月10日),对氟康唑和伊曲康唑均敏感,因为患者肌酐高,肾功能异常,故给予米卡芬净和氟康唑抗真菌治疗。患者血糖高,2月6日末梢血血糖33.1mmol/L,给予胰岛素强化治疗,但是血糖控制不佳,一直在11mmol/L以上。同时给予化痰、抗炎、保肝、营养神经、调节机体免疫、加强营养、维持内环境稳定、对症支持等治疗。
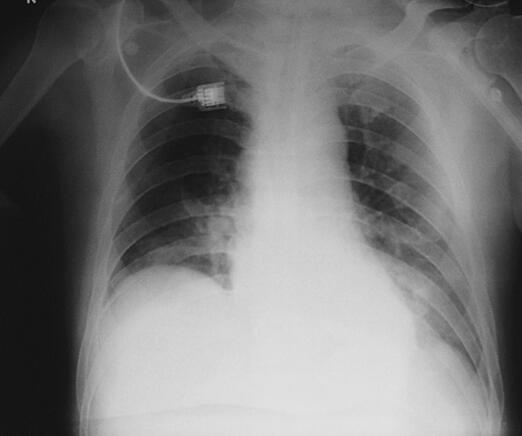
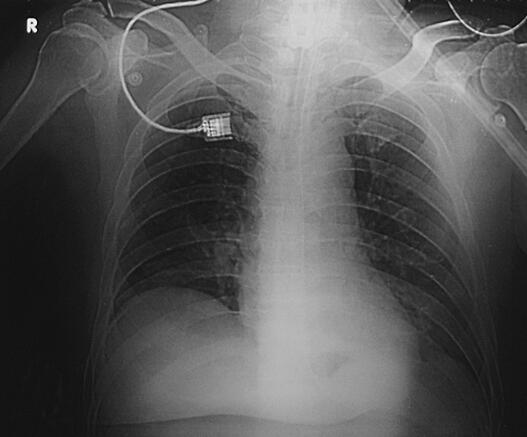
图2 2月9日胸片
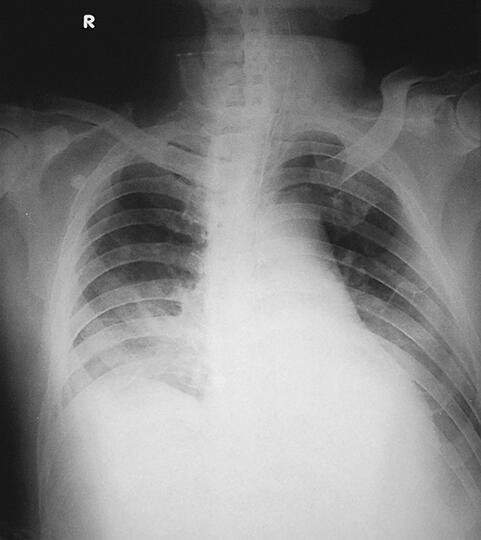
图3 2月10日胸片
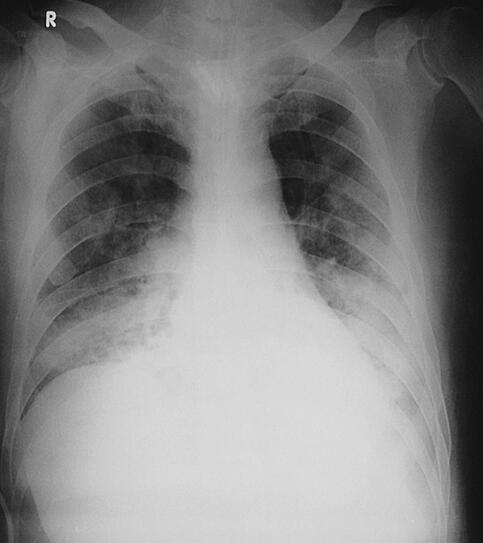
图4 2月13日胸片
最终诊断:①双侧支气管肺炎;②侵袭性念珠菌感染(血流感染);③脓毒症休克MODS(心、肺、肝、肾、血液);④颈前路减压植骨融合内固定术后;⑤颈椎后韧带骨化症。
治疗和转归:患者病情曾一度好转,2月10日停用血管活性药物后血压维持在130/80mmHg左右,血常规白细胞计数和中性粒细胞较前明显下降。但患者多次血培养结果提示白念珠菌,痰培养鲍曼不动杆菌,抗真菌和抗感染效果不佳,逐渐出现了多脏器功能衰竭(循环、肺、肾、血液系统)。大剂量血管活性药(多巴胺和去甲肾上腺素)维持下,心率、血压进行性下降,呼吸机吸氧浓度100%,但氧饱和度也只有60%~70%,于2月15日自动出院。
重要提示
1.老年男性,颈前路减压植骨融合内固定术后,急性起病。
2.术前超声心动图提示各项指标均正常,但是转入笔者科室后复查超声心动图,射血分数明显下降,左心室收缩末内径增大,老年男性手术、麻醉、感染等打击后心脏功能受累。
3.多次血培养结果提示白念珠菌,痰培养鲍曼不动杆菌,提示真菌血症,抗感染疗程长。
4.血糖最高达33.1mmol/L,给予胰岛素强化治疗,但是血糖一直在11mmol/L以上,血糖一直控制不佳也是脓毒症难以治愈的原因之一。
【讨论】
脓毒症是指由感染引起的全身炎症反应综合征。全身或局部感染均会引起脓毒症,造成多脏器功能损害,心脏是脓毒症的易损靶器官之一。研究显示,大约40%~50%脓毒症患者合并可逆性心功能不全,约7%的患者出现严重心力衰竭。脓毒症导致的心肌损伤是造成脓毒症预后不良的重要原因之一,病死率约为50%~70%。
脓毒症造成心肌细胞损伤的原因是多方面的,目前认为主要包括以下几个方面:
1.循环中的心肌抑制性物质对心肌的损害,过度表达的促炎细胞因子,抑制了心脏收缩功能,导致心功能障碍。NO释放过多,参与心肌损伤,导致低血压。
2.心肌细胞内钙稳态失调,导致心肌的收缩和舒张功能受损,影响心脏功能。
3.脓毒症时,心肌线粒体功能障碍,导致能量代谢异常,细胞从有氧代谢转为无氧糖酵解,产生ATP减少,从而细胞发生凋亡或坏死。
4.循环与微循环改变,通常与血管内容量缺失、血管舒张致血流分布异常有关。心脏充盈不佳、前负荷不足必然导致心排血量减少。
该患者术前超声心动图提示心脏射血分数、房室各腔内径均正常。但是转入笔者科室后,复查超声心动图射血分数明显下降,左心室收缩末内径增大,提示脓毒症已造成了患者的心肌细胞损伤,导致心脏收缩功能下降,并出现了低血压、窦性心动过速、室性期前收缩等心律失常,加重血流动力学紊乱,促进了休克和MODS的发生。
2008年严重脓毒症和脓毒性休克治疗指南中指出,对有心功能障碍的脓毒症患者推荐使用多巴胺,可提高心脏充盈压和降低心脏输出,但是不推荐应用药物把心脏指数增加到高于正常值的预设水平。维持平均动脉压≥65mmHg,中心静脉给予去甲肾上腺素和多巴胺是首选升压药。该患者刚转入笔者科室时,给予多巴胺、去甲肾上腺素升压治疗,病情曾一度好转,停用血管活性药物后血压维持尚可,考虑此时患者的心功能不全是可逆性的。但因为感染严重,最后心功能衰竭,即使加大血管活性药物的浓度,效果仍不佳,心率、血压进行性下降。有研究显示,胰岛素强化治疗在达到目标血糖控制后可以有效改善患者心肌抑制及促进心功能的恢复,其可能机制为胰岛素具有多种非降糖作用,包括抑制炎症反应、抗氧化作用、保护血管内皮、扩张血管、抗血小板聚集、抗动脉粥样硬化及心脏保护作用。该患者在转入笔者科室前在骨科检查末梢血血糖高达33.1mmol/L,给予胰岛素强化治疗,但是血糖控制仍不佳,这可能也进一步造成了心肌的损伤。在脓毒症心血管功能障碍的治疗进展方面,目前最热门的当属他汀类药物,具有抗炎、抗氧化、改善内皮系统功能、提高NO生物有效性等多向性效应。近年研究显示,运用他汀类药物治疗脓毒症病死率总体降低,有望成为脓毒症心血管功能障碍的新的治疗方向。
有效预防和治疗心肌损伤是脓毒症治疗的重要组成部分,对脓毒症心肌损伤的防治应针对可能的相关机制进行,才能尽可能降低心肌损伤的发生,并改善脓毒症的临床预后。因此了解脓毒症时心血管的改变对于临床医师救治脓毒症患者有着极其重要的意义。
【专家析评】
通过该病例,强调围术期抗生素的合理使用非常重要,尤其是年老体弱、糖尿病、多次大手术、大量应用糖皮质激素等情况下,一定要避免强效、广谱、长时间使用抗生素。出现侵袭性念珠菌感染后,更要早期、足量、联合使用敏感抗真菌药物。针对感染性休克,在积极纠正原发病的基础上,有效的复苏十分必要,首先要做到循环容量的维持,要用尽可能小的容量达到循环容量的稳定;保持血氧携带能力,尽量减轻水肿;恢复凝血状态,保持内环境稳定,尽快稳定循环与良好灌注。力争6小时内达到复苏目的,即中心静脉压(CVP)达到8~12cmH2O;平均动脉血压≥65mmHg;尿量≥0.5ml/(kg·h);以及中心静脉或混合静脉血氧饱和度(SCVO2或SVO2)≥70%。同时,菌毒并治、积极器官支持是救治成功的必要手段。
参考文献
1. Angus DC,Linde-Zwirble WT,Lidicker J,et al. Epidemiology of severe sepsis in the United States:analysis of incidence,outcome,and associated costs of care. Crit Care Med,2001,29(7):1303-1310.
2. Krishnagopalan S,Kumar A,Parrillo JE. Myocardial dysfunction in the patient with sepsis. Curr Opin Crit Care,2002,8(5):376-388.
3. Fernandes CJ Jr,Akamine N,Knobel E. Myocardial depression in sepsis. Shock,2008,30(Suppl 1):14-17.
4. Rudiger A,Singer M. Mechanisms of sepsis-induced cardiac dysfunction. Crit Care Med,2007,35(6):1599-1608.
5. Nogueira AC,Kawabata V,Biselli P,et al. Changes in plasma free fatty acid levels in septic patients are associated with cardiac damage and reduction in heart rate variability. Shock,2008,29(3):342-348.
6. Van den Berghe G. How does blood glucose control with insulin save lives in intensive care? J Clin Invest,2004,114(9):1187-1195.
7. Marfella R,Di Filippo C,Portoghese M,et al. Tight glycemic control reduces heart inflammation and remodeling during acute myocardial infarction in hyperglycemic patients. J Am Coll Cardiol,2009,53(16):1425-1436.
(环球医学编辑:余霞霞)
免责声明
版权所有©人民卫生出版社有限公司。 本内容由人民卫生出版社审定并提供,其观点并不反映优医迈或默沙东观点,此服务由优医迈与环球医学资讯授权共同提供。
如需转载,请前往用户反馈页面提交说明:https://www.uemeds.cn/personal/feedback
来源:《急诊临床病案评析:感染与心血管性疾病》
作者:陈旭岩 王仲
页码:193-198
出版:人民卫生出版社





 Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.