外科手术是可切除胃肠间质瘤(gastrointestinal stromal tumor,GIST)的首选治疗方法,但对于中高危患者而言,单纯手术往往难以实现长期生存。随着c-KIT/PDGFRA 基因功能性突变的发现,胃肠间质瘤的核心发病机制逐渐被揭示。与此同时,伊马替尼的成功应用开创了肿瘤靶向治疗的新时代,将晚期胃肠间质瘤的预后从既往生存期不足12个月提升至10年生存率超过30%。然而,随着药物治疗时间的延长,继发性耐药和肿瘤进展成为临床上面临的主要挑战。在漫长的疾病管理过程中,复杂的病情演变、二线与三线治疗药物的选择、新型靶向药物的应用,以及外科手术与内科治疗的协同配合,始终是临床医生和患者共同关注的话题。
[病例摘要]
患者,男性,36岁,2012年9月26日因“吞咽阻塞感伴左肩疼痛3个月”就诊于福建医科大学附属协和医院。患者3个月前出现吞咽阻塞感,无法进食,上腹闷胀不适,伴左肩部疼痛,呈持续性,与体位无明显关系。无反酸、嗳气等症状。曾在当地医院按“胃炎”予治疗后症状无缓解。于4天前在当地医院行胃镜检查,示“胃底贲门区黏膜下巨大隆起型病变,考虑肿瘤”。遂转诊至福建医科大学附属协和医院,门诊拟“胃底贲门区占位性病变”收住院。发病以来,患者体重减轻3kg。
既往史及家族史
既往体健,否认药物过敏史;父母健在,家族中无类似病史。
体格检查
生命体征平稳,浅表淋巴结(-)。心肺体检未见异常。腹软,左上腹可触及大小约15cm×10cm肿物,质韧,界欠清,活动度差,加压后稍疼痛,肝脾肋下未触及。直肠指诊:未见异常。
辅助检查
血常规:白细胞 9.5×109/L,血红蛋白 114g/L,血小板331×109/L。
凝血功能:纤维蛋白原 4.98g/L,D-二聚体 5.17μg/ml。
肿瘤标志物:CEA1.9µg/L,CA19-9 4.66U/ml。
全腹部增强CT:左上腹软组织肿块,大小约16.4cm×12.3cm,考虑胃底大弯侧来源GIST伴左侧膈肌侵犯可能性大,需与淋巴瘤、神经鞘瘤、平滑肌瘤等其他胃黏膜下少见肿瘤鉴别(图1、图2)。
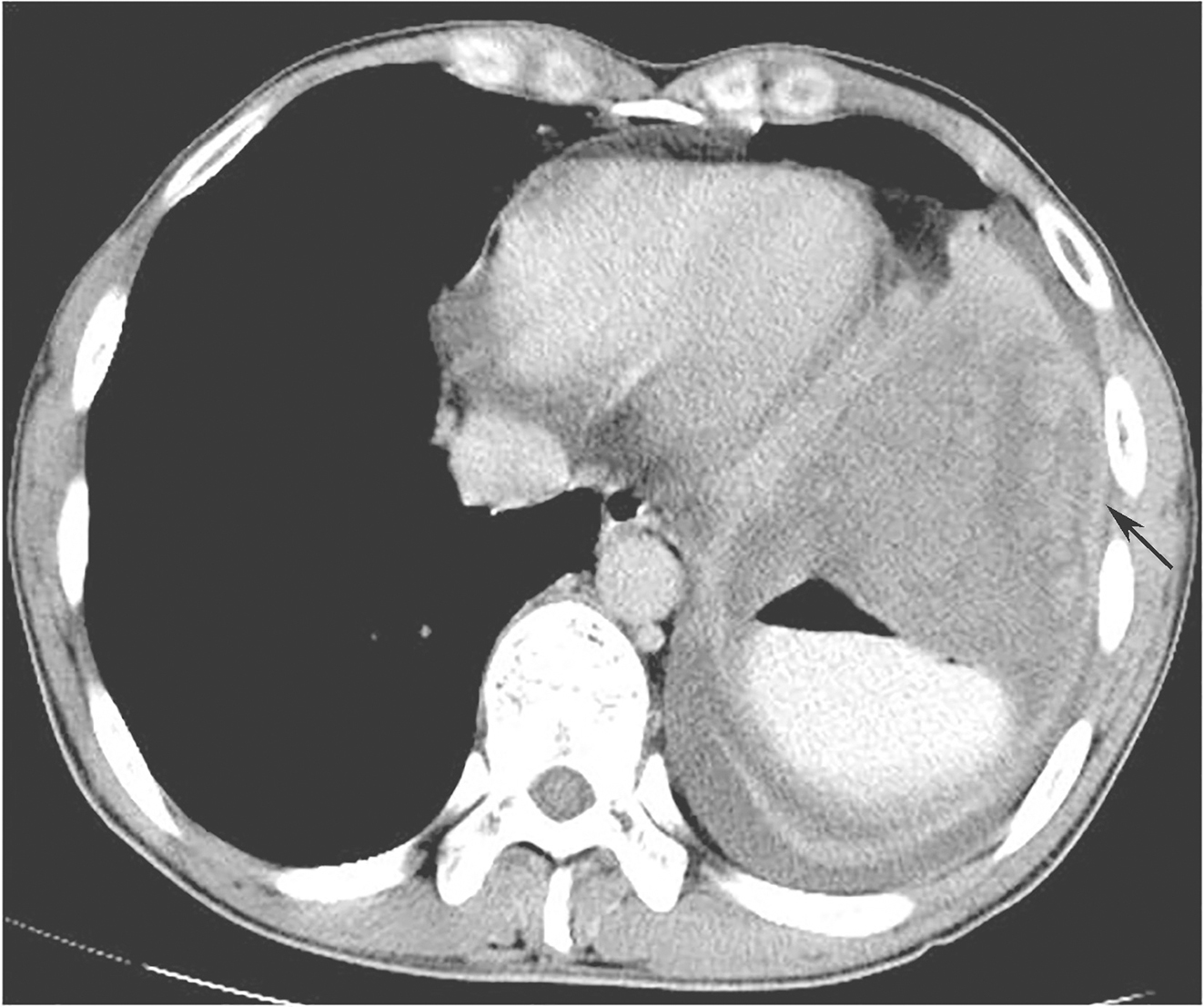
图1首诊全腹增强CT示胃底大弯侧来源GIST
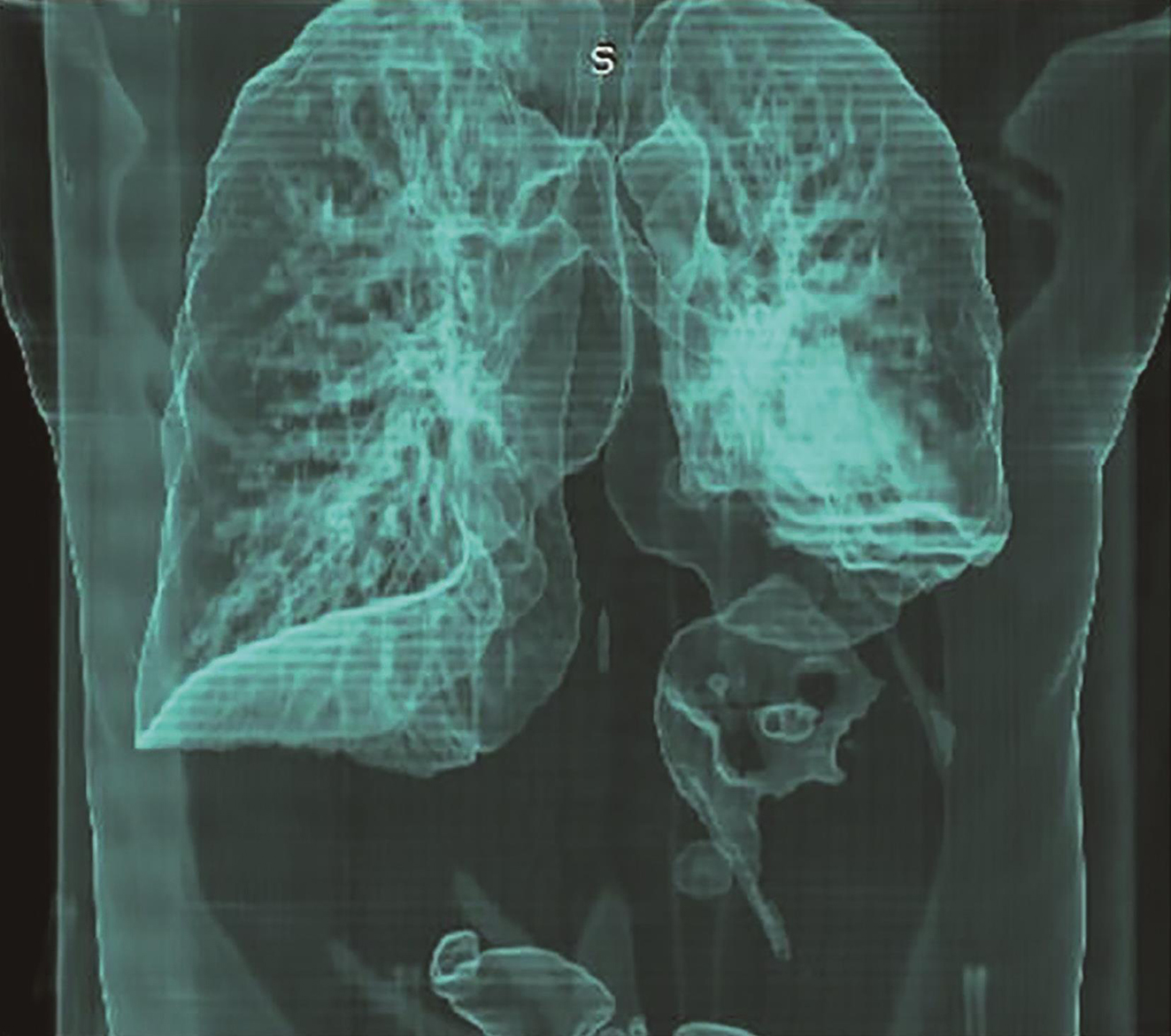
图2首诊CT三维重建示左侧膈肌侵犯可能性大
超声胃镜:胃底黏膜下肿物,固有肌层GIST?予穿刺活检。
穿刺活检:(胃底肿物穿刺活检)见梭形细胞呈束状排列,细胞呈轻度异型,核分裂象2 个 /50HPF。CD117(+),CD34(+),DOG-1(+),SMA(-)。
病理诊断:(胃)胃肠间质瘤
初步诊断
胃底贲门区巨大胃肠间质瘤
[治疗过程]
术前治疗
第一次MDT讨论意见:患者肿瘤体积巨大,可疑侵及膈肌,R0切除难度大,易出现手术相关并发症,建议行“伊马替尼400mg/d”方案术前治疗,注意疗效评估,根据治疗转归制订后续治疗方案。
于2012年10月13日开始口服伊马替尼400mg/d 治疗。治疗3个月后CT评估肿瘤大小为120mm×87mm,治疗6个月后CT评估肿瘤大小为92mm×65mm。治疗8个月后CT示:胃底大弯侧GIST,伊马替尼治疗后,肿瘤明显退缩,大小为89mm×63mm,病灶与左侧膈肌接触面缩小,分界较前清晰(图3)。此间规律口服伊马替尼,主要不良反应为1~2度食欲减退、乏力、手足综合征,未予特殊处理,自行缓解。
手术治疗
2013年5月23日第二次MDT讨论意见:患者经过8个月术前治疗,肿瘤退缩,病灶与左侧膈肌分界较前清晰,疗效评价PR。与治疗后6个月比,肿瘤退缩速度减缓,考虑已达最佳疗效,有手术指征,限期手术。
于2013年5月29日行“全胃切除术”。术中探查见:无明显腹水,肿瘤位于胃底大弯侧,大小约9cm×7cm,表面无破溃,胃周未见明显肿大淋巴结,肝脏、腹膜、盆腔未见肿瘤。手术过程顺利,肿瘤R0切除,未出现肿瘤破裂等术中并发症。
术后病理及基因检测
术后病理:(胃)胃肠间质瘤,梭形细胞型肿瘤伴出血、坏死、囊性变及炎细胞浸润,部分区域肿瘤细胞密度减低,间质伴玻璃样变,肿瘤大小9cm×9cm×7cm,核分裂象31个/50HPF,肿瘤浸润胃壁浆膜层,无破裂,切缘未见肿瘤,8枚淋巴结未见转移。
基因检测结果:c-KIT 外显子11缺失突变。
术后辅助治疗
患者术后恢复顺利,于术后3天肛门排气,术后7天进食半流质饮食,并开始口服伊马替尼400mg/d治疗。每3~6个月复查肺及全腹CT,未见肿瘤复发转移。
二线治疗
术后口服伊马替尼400mg/d辅助治疗30个月后(2015年11月18日),患者再次出现“吞咽阻塞感”,再次查腹部CT示:吻合口处可见新增团块状软组织肿物(51mm×49mm),增强后不均匀强化,考虑吻合口GIST复发。肝右前叶缘包膜新增软组织结节(36mm×20mm),腹腔新增软组织结节,考虑多发腹膜转移(图4)。行肝包膜下肿物穿刺基因检测:c-KIT外显子11缺失突变,c-KIT 外显子13点突变。
第三次MDT意见:①肿瘤吻合口复发,疑累及食管下段,伴右肝包膜及腹膜转移;②一般情况欠佳(贫血、低蛋白血症),无法耐受扩大手术;③若手术切除,行食管空肠无张力吻合可能性小。综上,建议以非手术治疗为主。因患者为11外显子突变继发13外显子点突变,根据文献资料,建议换用舒尼替尼。
2016年1月4日,开始口服舒尼替尼37.5mg/d,连续用药。此间出现高血压、手足综合征、乏力等1~2度不良反应,未予特殊处理,自行缓解。每3个月复查全腹CT。口服舒尼替尼3个月、6个月、9个月后吻合口病灶大小分别为:51mm×49mm、35mm×26mm、31mm×15mm,肝被膜下病灶分别为:36mm×20mm、21mm×6mm、21mm×5mm,最佳疗效PR(图5)。
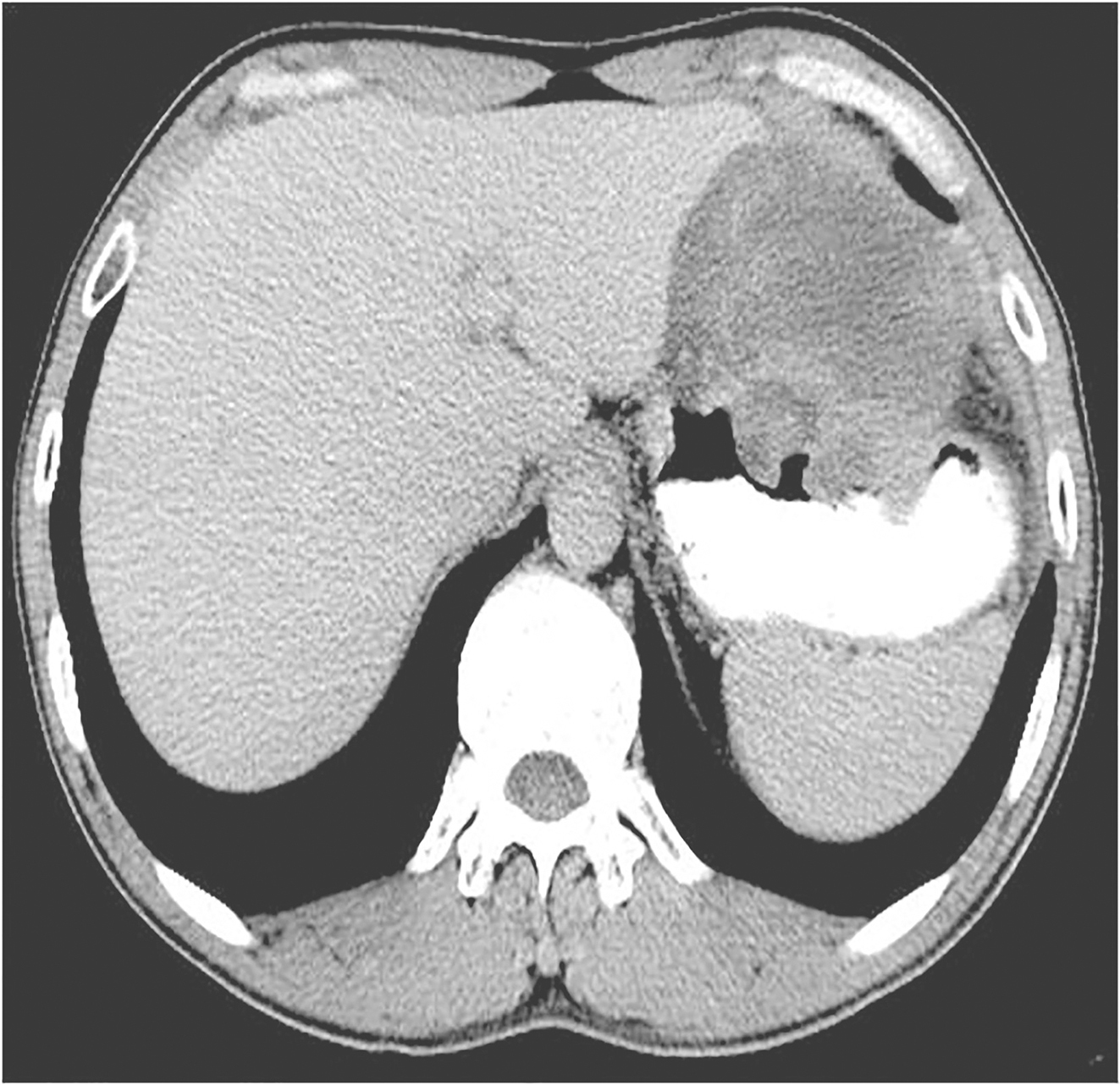
图3术前治疗8个月后全腹增强CT
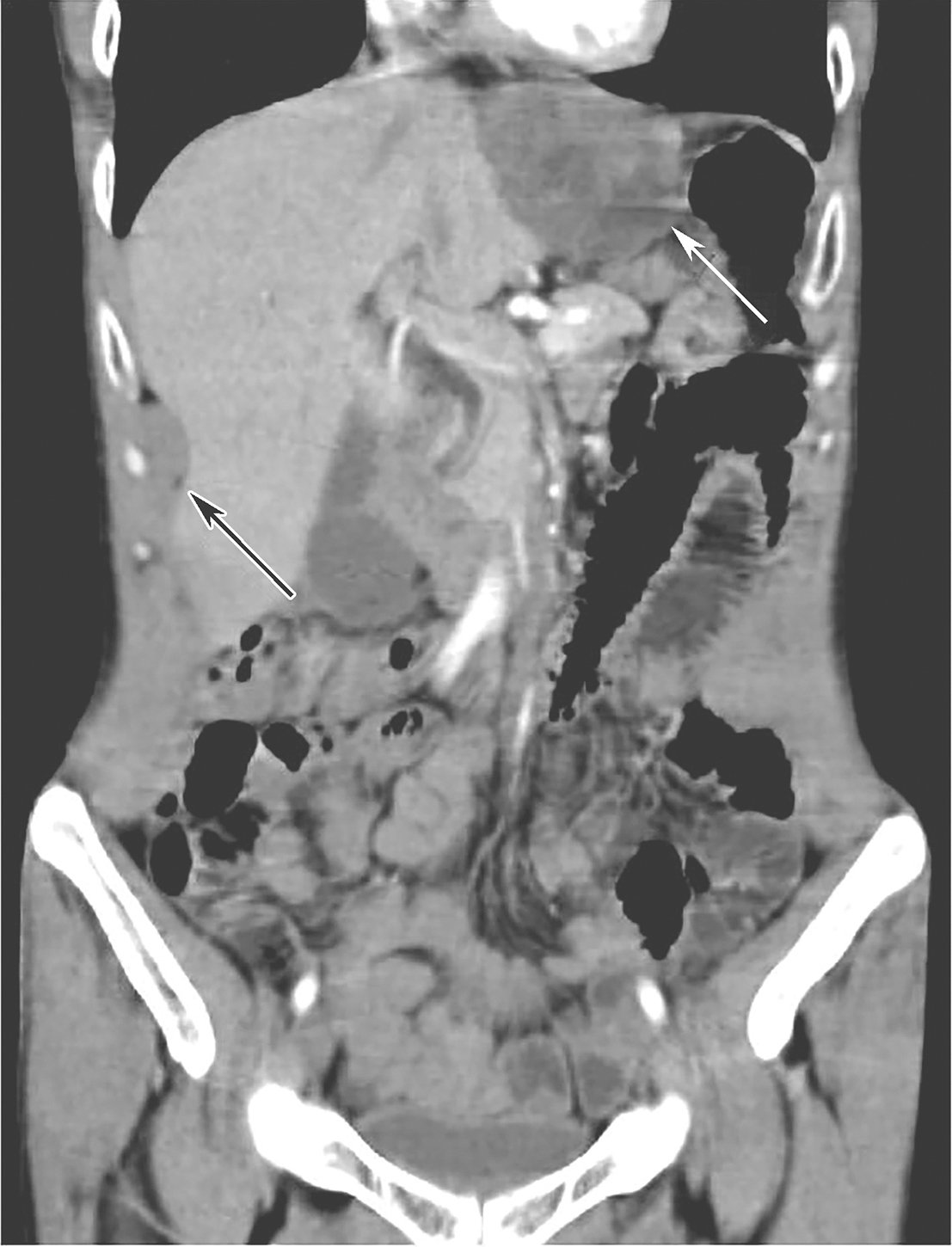
图4伊马替尼辅助治疗30个月后全腹增强CT(冠状位)
白色箭头示吻合复发病灶,黑色箭头示肝包膜转移灶
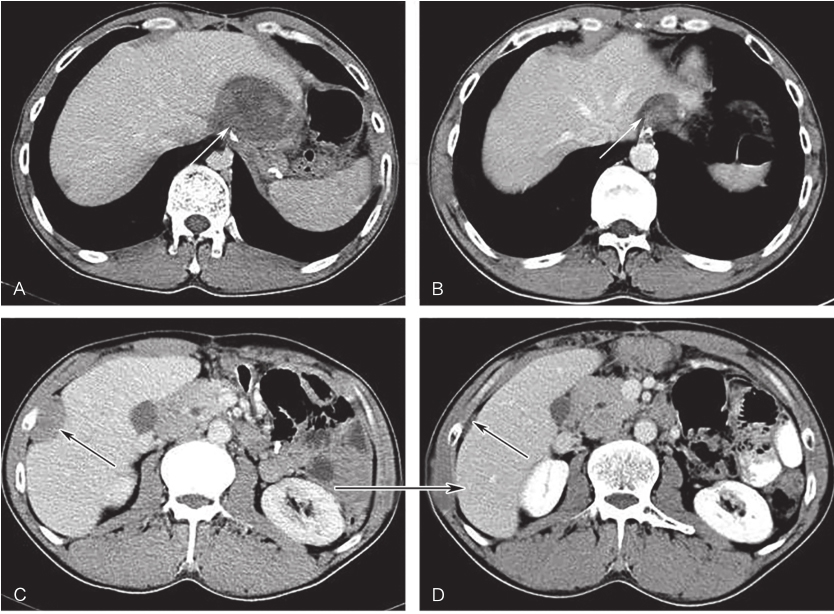
图5舒尼替尼治疗9个月后增强CT表现
A、C.治疗前病灶;B、D.治疗9个月后病灶;白色箭头示吻合复发病灶,黑色箭头示肝包膜转移灶
三线治疗
口服舒尼替尼15个月(2017年2月6日),腹部CT示:吻合口病灶48mm×38mm(PD),肝被膜下病灶:21mm×5mm,腹腔多处新增病灶。
第四次MDT意见:二线舒尼替尼耐药,根据文献及患者经济情况,予三线治疗,选用伊马替尼+舒尼替尼联合治疗。2017年2月20日开始口服伊马替尼300mg/d +舒尼替尼37.5mg/d治疗。此间每3个月复查腹部CT。主要不良反应为Ⅰ~Ⅱ度恶心、乏力、手足综合征、白细胞减少,患者无中断用药。
联合用药治疗3个月后,复查CT示吻合口病灶4.6cm×3.9cm,治疗后6个月CT示吻合口病灶3.8cm×3.0cm,肝被膜下及腹腔内病灶与前相仿,未见新发病灶(图6)。联合用药治疗后14个月及19个月CT示:吻合口病灶4.4cm×3.3cm,5.2cm×4.9cm(PD)。
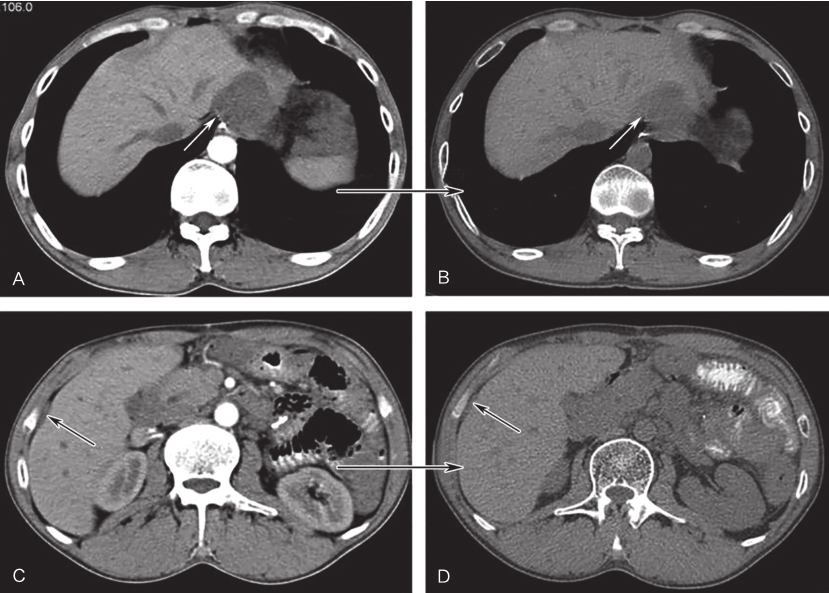
图6伊马替尼联合舒尼替尼治疗6个月后CT增强表现
A、C.治疗前病灶;B、D.治疗6个月后病灶;白色箭头示吻合复发病灶,黑色箭头示肝包膜转移灶
[经验与体会]
GIST标准剂量伊马替尼耐药后的治疗
基因继发性突变是胃肠间质瘤(GIST)产生继发性耐药的主要原因。在伊马替尼(400 mg/d)标准治疗失败后,应根据耐药机制选择个体化的二线治疗方案。伊马替尼增加剂量可能克服因血药浓度不足导致的“假性耐药”,约1/3患者可再次从中获益,但需注意可能伴随的不良反应增加。舒尼替尼作为标准二线治疗可改善患者生存,亚组分析显示其在c-KIT外显子9突变或野生型GIST患者中获益更为显著。进一步的耐药基因分析表明,对于继发c-KIT外显子13和14突变患者,舒尼替尼的疗效优于外显子17和18突变患者。体外实验还发现,索拉非尼对继发外显子17突变的GIST细胞系具有抑制活性,这为特殊耐药类型患者的药物选择提供了新的思路。
舒尼替尼二线治疗失败后的治疗选择
作为多靶点酪氨酸激酶抑制剂,舒尼替尼在GIST二线治疗约18个月后仍会面临新的耐药问题。GRID研究推荐瑞戈非尼作为伊马替尼和舒尼替尼治疗失败后的三线选择,其疗效显著优于安慰剂。Ⅲ期临床试验RIGHT表明,对于既往伊马替尼治疗有效的患者,三线治疗时重新启用伊马替尼仍可获益。PAZOGIST研究结果显示,帕唑帕尼用于GIST三线及以上治疗时,其总生存期优于最佳支持治疗。对于如本病例所示、因各种原因无法获得更多三线药物的患者,不应轻易放弃治疗。在优化给药方案的基础上,重新联合使用既往有效的伊马替尼与舒尼替尼,仍可安全、有效地延长患者生存期,甚至可能获得意外疗效。对于如本病例所示、因各种原因无法获得更多三线药物的患者,不应轻易放弃治疗。在优化给药方案的基础上,重新联合使用既往有效的伊马替尼与舒尼替尼,仍可安全、有效地延长患者生存期,甚至可能获得意外疗效。
外科手术在局部进展GIST中的作用
高肿瘤负荷通常提示GIST患者预后不良,因此肿瘤减负荷手术被尝试用于治疗复发转移性GIST。GIST的耐药进展多表现为局部进展,多个单中心、小样本回顾性研究已证实该术式在此类患者中的安全性和有效性。手术旨在完整切除耐药病灶,并在风险可控前提下尽可能多地切除治疗仍有反应的病灶,从而最大限度地减少需接受进一步药物治疗的肿瘤细胞数量,降低继发突变风险。联合术后靶向治疗,该策略可有效延长患者的无进展生存期和总生存期。然而,多项研究也表明,对于广泛进展的患者,减瘤手术不仅未能改善总生存期,反而会增加严重手术并发症的风险。然而,多项研究也表明,对于广泛进展的患者,减瘤手术不仅未能改善总生存期,反而会增加严重手术并发症的风险。
免责声明
内容来源于人卫知识数字服务体系、人卫inside知识库,其观点不反映优医迈或默沙东观点。 此服务由优医迈与胤迈医药科技(上海)有限公司授权共同提供。
如需转载,请前往用户反馈页面提交说明:https://www.uemeds.cn/personal/feedback
人卫知识数字服务体系





 Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
