30岁男性,20个月前“感冒”1周后出现颜面及双下肢水肿。10年前经血液感染丙型肝炎病毒,未治疗。主要表现为大量蛋白尿、伴变形红细胞尿和高血压,血肌酐水平间断升高,经糖皮质激素治疗后血肌酐水平可降至正常。如何诊治?
男性,30岁。
主诉
颜面及双下肢水肿20个月。
现病史
患者20个月前“感冒”1周后出现颜面及双下肢水肿。当地医院检查:血压升高;尿蛋白(+++),潜血(+++);ALB 30.5g/L,SCr 247μmol/L;C3 和 C4 下降;抗丙型肝炎病毒(HCV)抗体(+),HCV-RNA 3.09×104copies/ml;行肾活检诊断毛细血管内增生性肾小球肾炎;予泼尼松60mg/d及利尿治疗;血肌酐水平可降至正常,尿蛋白持续阳性。患者自行将泼尼松快速减停。之后多次于水肿加重、尿蛋白增加时加用激素,水肿可好转,多于停用激素后水肿再加重,间断血肌酐升高,间断使用泼尼松、雷公藤、环磷酰胺(累积量8g)和依那普利。1月前患者水肿再次加重,伴多浆膜腔积液,当地予白蛋白、呋塞米及地塞米松后好转,复查尿蛋白(+++),为进一步诊治入我院。发病来,患者无发热、皮疹或关节肿痛,无光过敏或口腔溃疡。
既往史
10年前经血液感染丙型肝炎病毒,未治疗。余无特殊。
入院查体
血压130/90mmHg,心率80次/分,一般情况好,心肺腹查体未见明显异常;双下肢重度可凹性水肿。
辅助检查
尿检:蛋白(++),定量 5.04g/d;RBC 15~20/HP,变形为主;ALB 31.5g/L,SCr 93μmol/L,eGFR 89.4ml/(min·1.73m2)。
血常规:WBC 4.88×109/L,Hb 72g/L(大细胞性贫血),PLT 190×109/L。 贫血五项:叶酸5.82nmol/L↓,维生素B12106.00pmol/L↓,铁三项正常。肝功和凝血未见明显异常。
ESR 30mm/h,CRP 3.09mg/L,IgG 4.39g/L↓,IgA 和 IgM 正常。 C3 0.69g/L↓,C4 0.08g/L↓。 ALT、AST正常。 抗 HCV 抗体(+),HCV-RNA<1 000copies/ml,冷球蛋白(-)。RF<20U/ml。 乙肝五项:抗-HBc(+),余(-)。抗 HIV 抗体(-)。ANA、抗 ds-DNA 抗体和ENA谱均阴性。
双肾B超:左肾长13.5cm,实质厚1.7cm;右肾长13.4cm,实质厚1.7cm;双肾实质回声稍强,结构欠清晰。
初步诊断
慢性肾小球肾炎 毛细血管内增生性肾小球肾炎 慢性肾脏病2期
营养性贫血
诊断思路和临床诊治经过
患者中年男性,慢性病程,主要表现为大量蛋白尿、伴变形红细胞尿和高血压,血肌酐水平间断升高,经糖皮质激素治疗后血肌酐水平可降至正常;临床上符合慢性肾炎综合征。患者有慢性丙型肝炎病毒(HCV)感染,可引起肾损害。患者无其他肾小球疾病继发因素。HCV感染引起肾脏损害主要有三种:冷球蛋白血症肾损害、膜增生性肾小球肾炎(MPGN)和膜性肾病。患者血清冷球蛋白阴性,不支持冷球蛋白血症肾损害,MPGN或膜性肾病需肾活检病理证实。
肾活检免疫荧光:IgG(+++),C3(+++),C1q(++),κ(+++),λ(+++),余阴性,系膜区、毛细血管壁颗粒样沉积(图1)。光镜下可见37个肾小球,肾小球系膜细胞和基质重度弥漫增生,广泛插入,肾小球基底膜弥漫不规则增厚,双轨及多轨征形成,系膜区、内皮下嗜复红蛋白沉积,其中2个小细胞性新月体形成;肾小管上皮细胞空泡及颗粒变性,多灶状萎缩;肾间质水肿,多灶状淋巴和单核细胞浸润伴纤维化;小动脉管壁增厚;符合膜增生性肾小球肾炎(图2)。电镜下肾小球系膜细胞和基质重度增生,广泛插入,内皮细胞增生及肿胀,基底膜弥漫不规则增厚,内皮下和系膜区可见电子致密物,上皮足突广泛融合;符合膜增生性肾小球肾炎(图3)。因怀疑HCV相关,进一步进行相关检测:免疫组化染色发现HCVNS3(nucleostemin 3)抗原沿毛细血管壁和系膜区颗粒样沉积,免疫电镜显示HCV-NS3主要位于电子致密物内。因此,该患者的病理诊断符合HCV相关的膜增生性肾小球肾炎。入院后予干扰素抗病毒,依那普利、美托洛尔、叶酸、维生素B12及对症利尿治疗,患者血肌酐渐上升至174μmol/L,伴血钾上升,停用依那普利;加用泼尼松、环磷酰胺治疗,患者尿蛋白渐降至<1g/d,SCr稳定在130μmol/L左右,目前随访1年,病情稳定。
最终诊断
慢性丙型病毒性肝炎
HCV相关肾小球肾炎 HCV相关膜增生性肾小球肾炎 慢性肾脏病2期
营养性贫血

图1 HCV 相关膜增生性肾小球肾炎:IgG(+++),C3(+++),C1q(++),沿系膜区和毛细血管壁团块状和颗粒状沉积(免疫荧光×400)
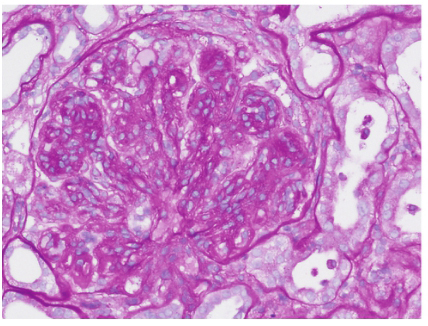
图2 HCV相关膜增生性肾小球肾炎(PAS×400)
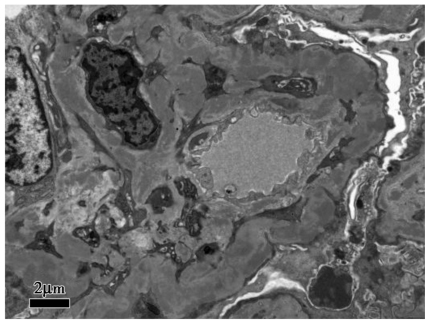
图3 电镜在内皮下、系膜区可见电子致密物沉积(×8000)
讨论
这是一HCV感染相关、非冷球蛋白血症肾损害、病理为MPGN的病例。HCV感染引起的肾脏损害表现多样,以冷球蛋白血症肾损害、MPGN和膜性肾病最为常见。其他少见还有结节性多动脉炎、局灶节段性肾小球硬化(FSGS)、弥漫增生性肾小球肾炎、纤维样或免疫触须样肾小球病等。
HCV感染不通过冷球蛋白血症引起MPGN(简称HCV相关MPGN)属于免疫球蛋白和补体均阳性的MPGN,目前认为其发病机制:HCV感染后,长期HCV抗原刺激机体产生抗HCV抗体,同时病毒不断复制产生抗原。抗原-抗体形成免疫复合物后沉积在肾小球系膜区、内皮下,通过经典途径激活补体,引起炎症反应,造成肾小球损伤。本例患者肾小球内HCV抗原与免疫球蛋白和补体分布位置类似、免疫电镜在电子致密物内检测到HCV抗原,支持肾脏病变与HCV感染相关。
HCV感染还可以通过冷球蛋白血症引起MPGN,表现为Ⅱ型或Ⅲ型冷球蛋白血症(混合性冷球蛋白血症),其发病机制:HCV慢性感染刺激机体产生抗HCV抗原的多克隆IgG抗体,机体和病毒相关的多因素参与下机体产生抗IgG的IgM型抗体(可为单克隆或多克隆,具有类风湿因子活性),HCV抗原-多克隆IgG-单克隆/多克隆IgM复合物在4℃时可沉淀,复温至37℃时可再溶解,被称为冷球蛋白,其易在组织(如小血管壁、肾小球)沉积,激活补体,从而引起组织损伤。
治疗上,对于HCV相关MPGN,在肾病综合征或血肌酐升高时,建议使用α干扰素,加用利巴韦林可能抗病毒效果更好,但利巴韦林在肌酐清除率小于50ml/(min·1.73m2)时需慎用,必要时监测血药浓度。同时还可选择血浆置换、rituximab、环磷酰胺联合糖皮质激素治疗。无禁忌证者需常规使用ACEI/ARB以减少尿蛋白和控制血压。
免责声明
内容来源于人卫知识数字服务体系、人卫inside知识库,其观点不反映优医迈或默沙东观点。 此服务由优医迈与胤迈医药科技(上海)有限公司授权共同提供。
如需转载,请前往用户反馈页面提交说明:https://www.uemeds.cn/personal/feedback
[1]JOHNSON R J,WILLSON R,YAMABE H,et al.Renal manifestations of hepatitis C virus infection[J].Kidney Int,1994,46(5):1255-1263.
[2]JOHNSON R J,GRETCH D R,YAMABE H,et al.Membranoproliferative glomerulonephritis associated with hepatitis C virus infection[J].N Engl J Med,1993,328(7):465-470.
[3]STEHMAN-BREEN C,ALPERSl C E,FLEET W P,et al.Focal segmental glomerular sclerosis among patients infected with hepatitis C virus[J].Nephron,1999,81(1):37-40.
[4]MARKOWITZ G S,CHENG J T,COLVIN R B,et al.Hepatitis C viral infection is associated with fibrillary glomerulonephritis and immunotactoid glomerulopathy[J].J Am Soc Nephrol,1998,9(12):





 Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
