43岁女性,3个月前无明显诱因出现双下肢对称性水肿,临床主要表现为肾脏受累,中度蛋白尿,伴少量血尿,肾功能正常,如何诊治?女性,43岁。
主诉
双下肢水肿3个月。
现病史
患者3个月前无明显诱因出现双下肢对称性水肿,我院门诊检查:尿蛋白1.4~1.7g/d,ALB 39.2g/L,SCr 72μmol/L。发病来,无皮疹、光过敏或关节肿痛。体重下降2kg。
既往史
高血压6年。个人史、婚育史、家族史无特殊。
入院查体
BP 150/80mmHg,P 84次/min,心肺腹查体未见明显异常;双下肢轻度凹陷性水肿。
辅助检查
尿检:蛋白(++),尿蛋白定量 2.48g/24h;RBC 3~8/HP,变形为主。ALB 33.9g/L;SCr 73μmol/L,CCr 125.51ml/min。
血常规:WBC 4.45×109/L,Hb 106g/L(正细胞正色素贫血),PLT 176×109/L;Coombs’试验(-)。 ESR 12mm/h;C 反应蛋白(CRP) 1.37mg/L;IgG、IgA 和IgM 正常;C3 0.46g/L↓,C4 0.11g/L↓;ANA、抗ds-DNA 及 ENA 谱均(-);ANCA(-);乙肝五项、抗 HCV 抗体和抗HIV抗体(-);冷球蛋白(-);类风湿因子(RF)(-);血、尿免疫固定电泳均未见单克隆区带;肿瘤标志物均正常。
胸片正常。超声心动图:左房饱满,余未见明显异常。B超:双肾大小正常。
初步诊断
慢性肾炎综合征 慢性肾脏病1期
高血压病2级,中危
诊断思路和临床诊治经过
患者中年女性,慢性病程,临床主要表现为肾脏受累,中度蛋白尿,伴少量血尿,肾功能正常;符合慢性肾炎综合征表现;临床及辅助检查无继发因素证据,考虑为原发性肾小球疾病。下一步需行肾活检明确病理类型,以指导治疗及判断预后。
入院后第8天行肾活检。免疫荧光:IgG(++),IgM(++),C3(+++),C1q(+++),κ(++),λ(++),余阴性,毛细血管壁、系膜区颗粒样沉积(图1)。光镜:可见12个肾小球,3个缺血性硬化,其余肾小球系膜细胞和基质弥漫重度增生,节段性内皮细胞增生,系膜广泛插入,基底膜弥漫增厚,双轨征形成,系膜区、内皮下嗜复红蛋白沉积;肾小管上皮空泡及颗粒变性,灶状萎缩;肾间质灶状淋巴和单核细胞浸润伴纤维化,小动脉管壁增厚;符合膜增生性肾小球肾炎(MPGN)(图2)。电镜:肾小球系膜细胞和基质重度增生,广泛插入,基底膜增厚,系膜区、内皮下大量电子致密物沉积,上皮细胞足突弥漫融合,肾小管和肾间质无特殊病变(图3)。符合Ⅰ型MPGN。
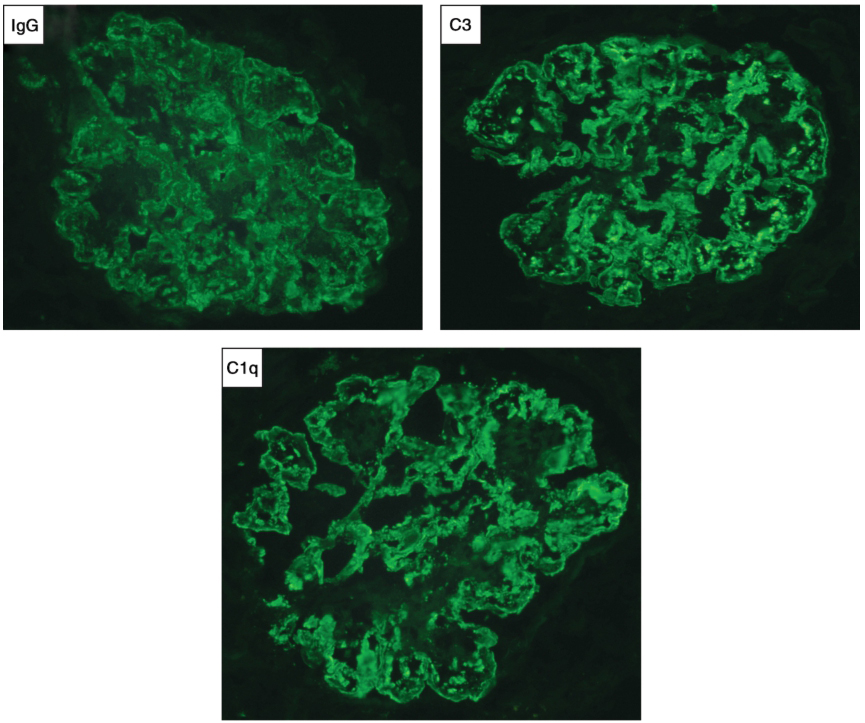
图1 特发性Ⅰ型膜增生性肾小球肾炎:免疫荧光IgG(++),C3(+++),C1q(+++),沿系膜区和毛细血管壁团块状和颗粒状沉积(×400)
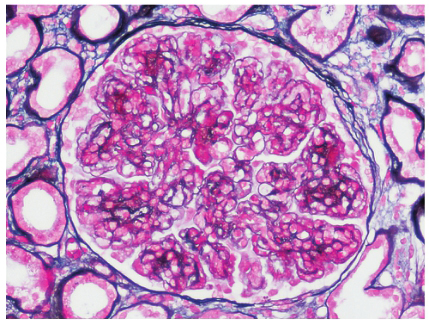
图2 特发性Ⅰ型膜增生性肾小球肾炎:肾小球呈分叶状,系膜细胞和基质增多,广泛插入,毛细血管壁增厚,双轨征形成。(PASM+Massom ×200)
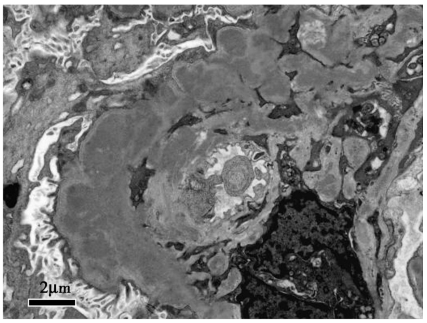
图3 特发性Ⅰ型膜增生性肾小球肾炎:电镜可见内皮下、系膜区大量电子致密物沉积(×10 000)
入院后予贝那普利10mg/d口服;肾活检病理诊断后,考虑患者临床表现轻,未使用激素或免疫抑制剂,出院前复查尿蛋白0.52g/d。1年后患者出现肾病水平蛋白尿,血肌酐正常,加用泼尼松,并先后联合环磷酰胺、环孢素A、来氟米特,尿蛋白减少至<1g/d。3年后患者SCr 350μmol/L,伴肾病综合征、尿红细胞增多、无菌性白细胞尿。再次检查仍无继发因素证据,行重复肾活检符合Ⅰ型MPGN,病变较前明显加重,对患者再次加强免疫抑制治疗,但无明显效果。3个月后患者进入终末期肾脏病,维持血液透析治疗。
最终诊断
慢性肾小球肾炎
免疫复合物介导的膜增生性肾小球肾炎
慢性肾脏病5期
高血压病2级,中危
讨论
这是一个典型的特发性免疫复合物介导的MPGN病例,患者在起病3年半后进入终末期肾脏病。MPGN的自然病程差异很大,临床可表现为无症状血尿和(或)蛋白尿、急性肾炎综合征、肾病综合征、慢性肾衰竭或急进性肾炎综合征。其临床表现的差异与各型发病机制不同有关。
MPGN的典型病理表现为光镜下系膜细胞增生伴系膜基质增多,并向内皮下插入,造成毛细血管壁增厚、双轨征形成(也有观点认为是新生的基底膜样物质,不是插入形成的)。既往MPGN分为特发性和继发性;继发性因素包括感染、自身免疫性疾病、肿瘤等;特发性MPGN根据电镜结果分为3型。Ⅰ型MPGN在内皮下可见电子致密物沉积,Ⅱ型MPGN(目前更倾向于称为致密物沉积病,DDD)在肾小球基底膜致密层见均质飘带状电子致密物沉积,Ⅲ型MPGN在内皮下和上皮下均可见电子致密物沉积。此种分型方法以形态学为依据,对于进一步探讨发病机制帮助不大。
因此,目前根据免疫荧光中免疫球蛋白(Ig)和补体的结果提出了新的MPGN分型方法。①多克隆免疫球蛋白和补体均阳性的MPGN:由于长期抗原刺激,循环中形成抗原-抗体复合物并在肾小球沉积,免疫复合物通过经典途径激活补体,从而造成肾小球损伤,主要见于慢性感染、自身免疫性疾病;②单克隆Ig沉积引起的MPGN:见于单克隆免疫球蛋白血症;③Ig阴性而补体C3阳性的MPGN:见于C3肾小球病(C3 glomerulopathy)。是由于补体旁路调节异常,补体旁路过度激活,补体成分在肾小球沉积引起炎症反应,从而造成肾小球损伤;④Ig和补体均阴性的MPGN:见于血栓性微血管病慢性化阶段,主要是由于各种原因造成内皮细胞损伤、内皮下沉积物及系膜溶解,之后肾小球进行修复、重塑后形成MPGN的病理改变。本例患者为多克隆免疫球蛋白和补体沉积引起的MPGN,但临床无感染或自身免疫病证据,暂时被归为“特发性免疫复合物介导的MPGN”。
旧分类的特发性MPGN多见于儿童和青年人,各种MPGN治疗方法的临床试验多来自儿童,而且缺乏随机对照研究。因其发病率低,多数临床试验的样本量小,观察的时间不长。此外,每个临床试验里Ⅰ、Ⅱ、Ⅲ型MPGN所含比例不同且多种机制参与MPGN发病,因此对于治疗的疗效分析极其困难。
比较实际的建议是:多克隆Ig和补体沉积的MPGN应该治疗原发病(感染、自身免疫性疾病)。非肾病水平蛋白尿、尿沉渣无活动性肾炎表现及肾功能正常、肾活检病理无肾小球硬化及新月体形成的患者长期预后相对较好,以控制血压和ACEI/ARB治疗为主。活动性病变可考虑使用糖皮质激素和免疫抑制剂(因多克隆Ig沉积,需考虑针对B细胞的免疫抑制治疗)。补体激活在MPGN发病中的作用提示新的治疗方向,如抗C5抗体等,但目前尚需要临床验证。
MPGN总体预后较差,针对其治疗及预后仍需要进一步的观察和研究。本例患者虽然开始临床表现轻(尿蛋白不多,血肌酐正常),后来出现大量蛋白尿,经过治疗后尿蛋白也明显减少,但实际病变始终存在,最终进展为终末期肾脏病。
免责声明
内容来源于人卫知识数字服务体系、人卫inside知识库,其观点不反映优医迈或默沙东观点。 此服务由优医迈与胤迈医药科技(上海)有限公司授权共同提供。
如需转载,请前往用户反馈页面提交说明:https://www.uemeds.cn/personal/feedback
人卫知识数字服务体系
[1]SETHI S,FERVENZA FC.Membranoproliferativeglomerulonephritis--a new look at an old entity.N Engl J Med,2012,366(12):1119-1131.
[2]CAMERON JS,TURNER DR,HEATON J,et al.Idiopathic mesangiocapillaryglomerulonephritis.Comparison of types I and II in children and adults andlong-term prognosis.Am J Med,1983,74(2):175-192.
[3]D’AMICO G,FERRARIOF.Mesangiocapillary glomerulonephritis.J Am Soc Nephrol,1992,2 (10 Suppl):S159-166.





 Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
