胃肠间质瘤(gastrointestinal stromal tumor,GIST)是消化道最常见的间叶源性肿瘤,发生在食管部位的最为少见,约占0.7%。中高危型GIST患者术后复发转移率高,主要为局部复发、腹腔转移和肝转移。发生骨转移者较为罕见,而食管胃肠间质瘤发生骨转移则更为少见。本文报道1例巨大食管GIST术后继发骨转移患者,结合相关文献讨论其临床治疗方法,希望能帮助临床工作者熟悉此类少见的胃肠间质瘤。
【病历摘要】
患者,女性,43岁,2015年12月1日因“进食梗阻”就诊于当地医院,自诉进食硬食时梗阻感明显,当地医院行胸部CT检查示:左侧胸腔13.3cm×12.2cm肿块,呈分叶状,其内密度均匀,与食管下段关系密切,考虑肿瘤性病变:胃肠间质瘤?患者为求进一步治疗,遂前往华中科技大学同济医学院附属协和医院胸外科就诊,门诊以“胸腔占位:食管胃肠间质瘤?”收入院。
(一)既往史及家族史
既往身体状况一般,否认肝炎、结核等传染病史,否认药物及食物过敏史;家族中无类似病史。
(二)体格检查
上腹部及右下腹轻度压痛,剑突下可及一包块,约拳头大小,边界不清,活动度可,肝脏脾脏肋下未触及,腹部叩诊无移动性浊音,肠鸣音正常。
(三)辅助检查
血常规:白细胞11.1×109/L↑,红细胞4.53×1012/L,血红蛋白128g/L,血小板187×109/L,中性粒细胞百分比80.87%↑,淋巴细胞百分比9.8%↓。
血生化:未见异常。
肿瘤标志物:大致正常。
胸部及上腹部增强CT(图1):①左后下纵隔处见巨大不规则肿块影,横截面约13.4cm×12.3cm,考虑肿瘤性病变:胃肠间质瘤?②左侧胸腔、心包少量积液。③肝脏多发类圆形无强化低密度影,考虑囊肿。
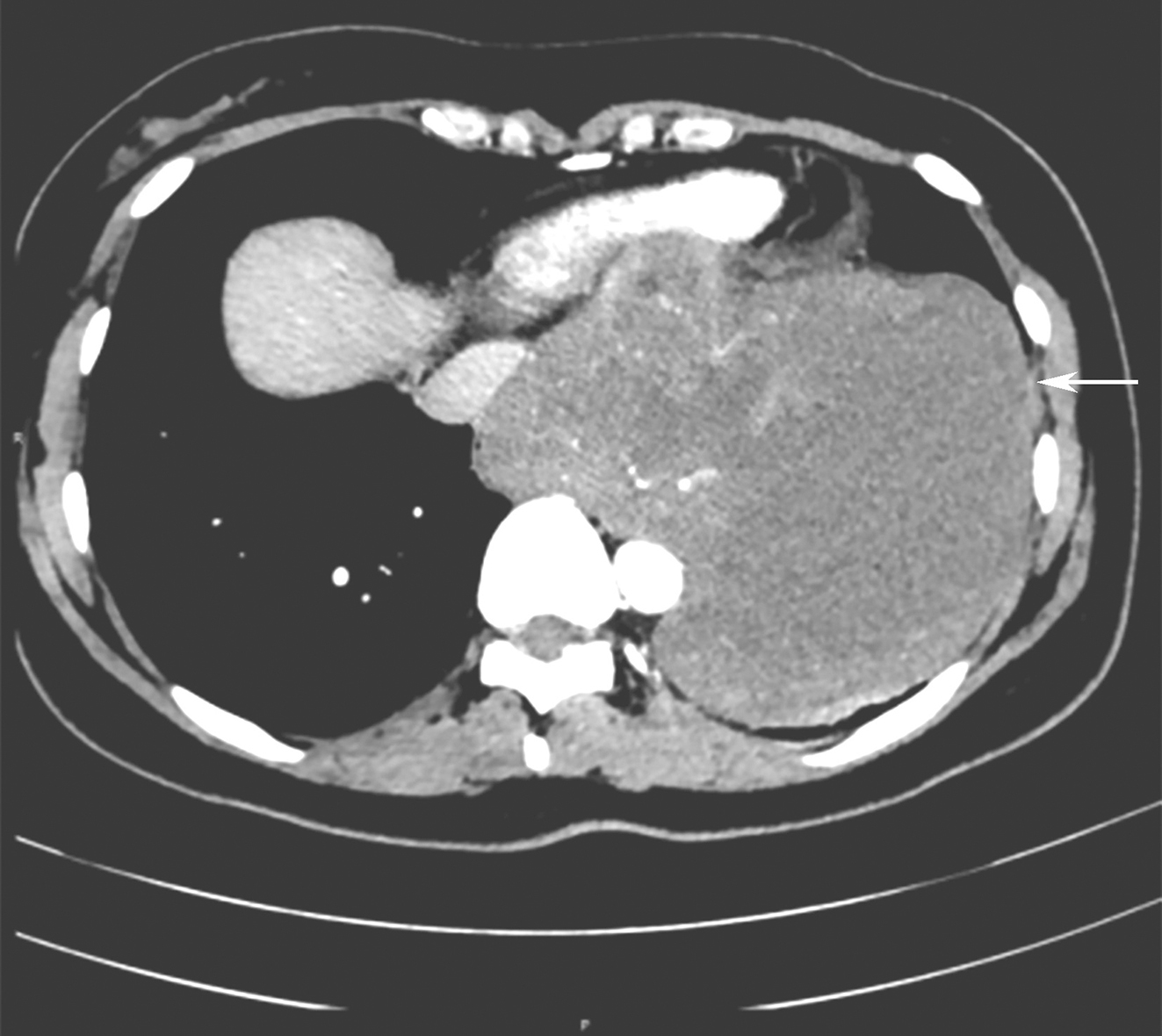
图1 术前CT检查
上消化道钡剂造影(图2):食管下段钡剂通过稍缓慢,局部管腔向右推移,管腔充盈欠佳,累及段长约8cm,余管壁柔软,黏膜规则,扩张可。多考虑食管下段外压性改变。
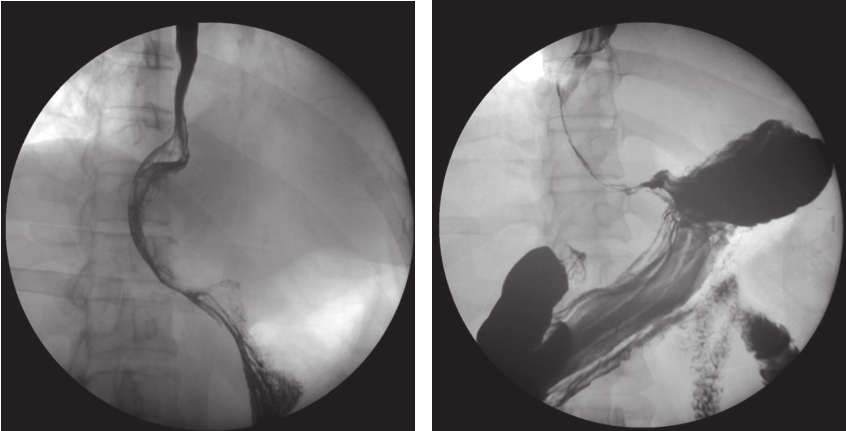
图2 术前钡剂造影
(四)初步诊断
1.食管占位性病变:胃肠间质瘤?
2.肝囊肿。
3.左肺下叶肺不张。
【治疗过程】
(一)病例分析
患者为中年女性,以“食管梗阻”就诊,影像学检查考虑食管下段肿瘤性病变,GIST可能性大。由于肿物最大径13cm,且位置与纵隔结构关系密切,术前活检风险大,遂未行术前活检。同时,巨大肿块占位效应可能影响周围结构功能,行肺通气及心脏超声检查评估心肺功能,未见明显异常,ECOG评分1分,ASA分级2级。考虑患者一般情况良好,原发肿瘤评估可切除,可行外科手术治疗,术后行病理检查和基因检测明确肿瘤性质,并指导术后治疗。
(二)治疗方案
2015年12月8日行手术探查,术中见胸腔部分粘连,可见少量淡黄色胸腔积液,左后下纵隔-心膈角处见巨大不规则肿块,横截面约13cm×12cm,侵犯食管肌层,食管、心脏、膈肌受压,界限欠清,左肺下叶部分肺不张,故行“食管肿物剥除术+食管全层修补术+胸腔穿刺置管引流术”,手术过程顺利。
(三)术后病理检测
病理结果示:(食管)胃肠间质瘤伴坏死、出血。肿瘤大小16.0cm×13.0cm×9.0cm,核分裂象>20个/50HPF,改良NIH危险度分级:高危。
免疫组织化学染色示:CD117(+),CD34(+),DOG-1(+),PCK(-),SMA(-),S-100(-),Ki67(Li:25%)。
基因检测:c-KIT基因外显子11发生突变,突变类型为557~558密码子缺失。
(四)术后疾病进展
术后7天患者恢复出院,建议其服用伊马替尼行辅助治疗,由于各种原因患者并未服药。
2016年3月,患者无明显诱因出现左髋部疼痛,休息时可缓解,行走时加重。当地医院CT示:双髋臼及左侧髂骨下部散在骨质破坏,伴局部软组织肿胀,骨转移瘤可能大。MRI示:左侧髂骨、髋臼及右侧髂骨骨质水肿,并左侧臀小肌肿胀,髂骨内、外侧筋膜水肿。笔者单位上消化道碘水造影示:食管下段局部毛糙,轻微囊状改变,碘水通过顺利,扩张度可,未见明显局限性狭窄及碘水外溢现象,贲门开放自然。
单光子发射计算机断层成像术(singlephoton emission computed tomography,SPECT)检查示(图3A):左侧髂骨、双侧髋臼骨质代谢异常活跃灶,考虑肿瘤骨转移可能。患者遵医嘱开始服用伊马替尼400mg/d。
2016年9月,笔者单位SPECT复查示(图3B):左侧髂骨、双侧髋臼、双侧耻骨骨质代谢轻度异常,较前片骨质代谢变化不明显。
2018年6月再次行SPECT检查示(图3C):第7~9胸椎左侧、双侧髂骨、双侧髋臼骨质代谢轻度异常活跃灶,较前相仿,未发现新病灶。
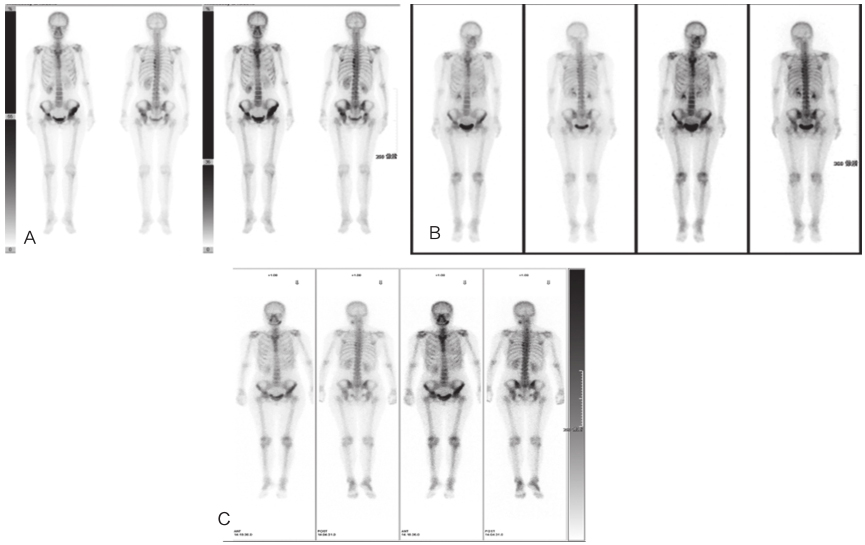
图3 SPECT
A.2016年3月;B.2016年9月;C.2018年6月
肺部CT示(图4):食管术后改变,左膈膨隆升高,食管下段稍积气扩张,未见明显管壁及软组织密度影。胆囊、脾脏、胰腺及双肾未见明显异常。
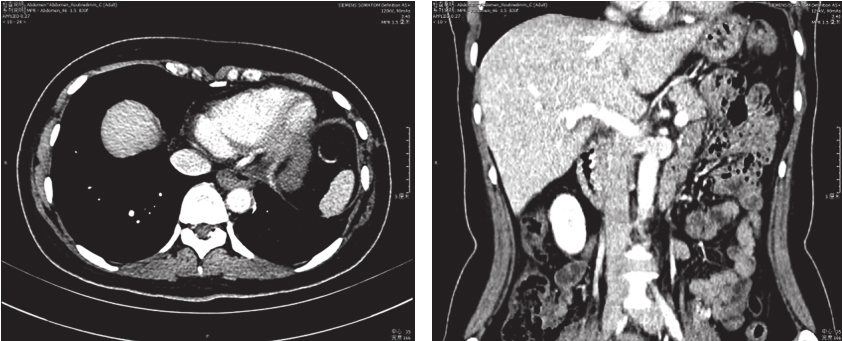
图4 术后CT复查
【预后】
截至2018年6月,随访30个月,患者伊马替尼辅助治疗27个月。目前患者骨病灶无明显进展,骨痛症状明显减轻,现继续服用伊马替尼400mg/d,服药期间患者无明显不良反应。
【经验与体会】
(一)食管胃肠间质瘤的临床特点、治疗及预后
随着医生临床经验的积累和诊疗技术的提高,食管GIST的确诊率也在不断提高。食管GIST最常发生于食管下段(约86.8%),其次是食管中段(约11.4%)及食管上段(约1.8%),常以进食梗阻为首发症状。本例是发生于食管下段的巨大GIST,考虑到术前活检风险大,可能出现肿瘤出血、破溃或肿瘤播散种植等严重后果,故未行术前活检。
传统的食管GIST手术方式大多以食管部分切除术为主。近年来,食管GIST手术方式趋于多样化。对于肿瘤最大径小于2cm,且超声内镜下无高危征象的GIST,可保守处理行内镜下监测。当出现肿瘤增长的证据或患者出现症状时,可进行内镜下切除术。肿瘤直径在2~6.5cm之间者,首选肿瘤摘除术。当肿瘤直径较大,可根据具体情况选择肿瘤摘除术或食管切除术,以完整切除肿瘤为原则。本例患者肿瘤最大径约13cm,侵犯食管肌层,故行食管肿物剥除术+食管全层修补术。
食管GIST缺乏大样本研究,较难探讨其预后特点。多数已发布的临床研究支持其预后相对于其他部位的原发胃肠间质瘤较差,有学者认为这同食管的组织学特点有关。另有研究报道完整切除食管肿瘤,预后较好。不过在靶向治疗的大背景下,食管胃肠间质瘤的预后特点仍需更多的临床数据才能阐明。
(二)胃肠间质瘤继发骨转移的诊断及治疗方法
GIST继发骨转移较少见,常见的骨转移部位是脊柱和骨盆,相比小肠和胃GIST,直肠GIST更容易继发骨转移。SPECT技术检测到特征性的溶骨性病变,病理学检查在骨病变中发现GIST细胞可做出骨转移诊断。本例患者GIST术后出现左髋部疼痛,行SPECT检查发现左侧髂骨、双侧髋臼骨质代谢异常活跃灶,考虑骨转移。患者遵医嘱开始服用伊马替尼,用药后骨痛症状明显减轻,但SPECT复查并未发现明显的病灶缩小,且患者未行骨组织活检,未能作出明确诊断,故目前考虑为GIST术后骨转移可能性大,患者病情仍在进一步观察中。
临床上治疗GIST继发骨转移的方法也相对较少,主要为药物治疗。伊马替尼可用于治疗晚期、复发性、不可切除或转移性的GIST。该患者出现骨痛症状后,行伊马替尼辅助治疗,骨痛症状明显减轻,表明辅助治疗有一定疗效。唑来膦酸是一种抗肿瘤药,可用于治疗实体瘤引起的高钙血症和骨转移,通过减少骨吸收,选择性地穿透破骨细胞并促进其凋亡,降低骨折和骨痛的发生频率,提高患者生活质量。另外,放疗和骨科手术也可用于治疗GIST骨转移,对疾病进程具有延缓作用,可以减少骨疼痛、预防病理性骨折和其他骨骼相关事件的发生。
文献报道,骨转移病灶是否累及脊柱可影响患者的预后,若累及脊柱预后可能较差。本例患者并没有累及脊柱,预后情况仍在进一步随访观察当中。
GIST继发骨转移较为罕见,但是随着患者预期寿命的增加以及成像技术的改进,更多的骨转移患者会被发现,我们应加强对其的认识,改进治疗方式,提高患者生活质量。另外,关于GIST继发骨转移的危险因素、分子背景、治疗反应和预后意义的数据较少,需要大样本研究。
【专家点评】
食管GIST发病率低,临床上少见,最易发生于食管下段,男性患者居多,缺乏特异性临床症状,主要以吞咽困难为主。内镜及影像学表现与食管平滑肌瘤相似,因此术前诊断食管GIST较为困难。对于食管GIST,是否行术前活检来明确诊断目前尚存在争议。考虑到术前穿刺活检可能出现肿瘤出血、破溃或肿瘤播散种植以及食管瘘等严重后果,NCCN指南并不推荐行术前活检。对于包块较大且与周围脏器分界不清、切除难度大的患者,术前活检是必要的。术前活检的目的是明确病变性质并行术前治疗使肿瘤降期,便于彻底切除。本例患者术前影像学检查明确肿瘤较大(13.4cm×12.3cm),且提示来源于食管的外压性肿瘤(黏膜下),术前在超声内镜下经食管黏膜穿刺活检,明确病变后实施术前治疗是一种很好的方案。手术治疗是食管GIST的主要治疗手段。食管GIST的主要手术方式有:内镜下切除、肿瘤摘除术和食管部分切除术。食管GIST手术方式的选择主要根据肿瘤大小来决定。该患者术后病理:肿瘤大小16cm×13cm×9cm,核分裂象>20/50HPF,改良NIH危险度分级高危。免疫组织化学染色示:Ki-67(Li:25%),提示高增殖能力;基因检测:c-KIT基因外显子11发生突变,突变类型为557-558密码子缺失,提示具有较高转移风险。这些结果强烈提示患者应该术后尽早服用伊马替尼辅助治疗并且服药时间要超过3年。根据《中国胃肠间质瘤诊断治疗共识(2017年版)》,对于中高危GIST患者术后应行靶向治疗,以防止疾病复发转移。然而本病例患者术后未行伊马替尼靶向治疗,术后3个月出现疑似骨转移情况,虽然没有病理结果证实骨转移,但是患者服用伊马替尼辅助治疗后骨痛症状明显减轻,且目前患者骨病灶无明显进展,说明靶向治疗有助于缓解食管GIST骨转移的病情。GIST患者发生骨转移较为罕见,食管的静脉网既可通过半奇静脉和奇静脉汇入到上腔静脉也可直接汇入到门静脉系统,这就造成食管GIST可能出现肺转移和骨转移。
免责声明
内容来源于人卫知识数字服务体系、人卫inside知识库,其观点不反映优医迈或默沙东观点。 此服务由优医迈与胤迈医药科技(上海)有限公司授权共同提供。
如需转载,请前往用户反馈页面提交说明:https://www.uemeds.cn/personal/feedback
人卫知识数字服务体系
[1] 中国临床肿瘤学会胃肠间质瘤专家委员会. 中国胃肠间质瘤诊断治疗共识 (2017年版)[J]. 肿瘤综合治疗电子杂志, 2018, 4(1): 31-43.
[2] SUPSAMUTCHAI C, WILASRUSMEE C, HIRANYATHEB P, et al. A cohort study ofprognostic factors associated with recurrence or metastasis of gastrointestinalstromal tumor (GIST) of stomach[J]. Ann Med Surg (Lond) , 2018, 35: 1-5.
[3] AKTAN M, KOC M, YAVUZ B B, et al. Two cases of gastrointestinal stromaltumor of the small intestine with liver and bone metastasis[J]. Ann Transl Med,2015, 3(17): 259.
[4] 陶凯雄, 张鹏. 胃肠间质瘤精准诊疗与全程化管理[M]. 武汉: 湖北科学技术出版社,2018: 40-41.
[5] COCCOLINI F, CATENA F, ANSALONI L, et al. Esophagogastric junctiongastrointestinal stromal tumor: resection vs enucleation[J]. World JGastroenterol, 2010, 16(35): 4374-4376.
[6] DI SCIOSCIO V, GRECO L, PALLOTTI M C, et al. Three cases of bonemetastases in patients with gastrointestinal stromal tumors[J]. Rare Tumors,2011, 3(2): e17.
[7] GOUVEIA A M, PIMENTA A P, LOPES J M, et al. Esophageal GIST:therapeutic implications of an uncommon presentation of a rare tumor[J]. DisEsophagus, 2005, 18(1): 70-73.
[8] JIANG P, JIAO Z, HAN B, et al. Clinical characteristics and surgicaltreatment of oesophageal gastrointestinal stromal tumours[J]. Eur JCardiothorac Surg, 2010, 38(2): 223-227.
[9] KANDA H, FURUTA N, TAKAZAWA Y, et al. Cytological Findings ofGastrointestinal Stromal Tumor-Derived Bone Metastasis[J]. Acta Cytol, 2018,62(5-6): 430-435.
[10] NAKANO A, AKUTSU Y, SHUTO K, et al. Giant esophageal gastrointestinalstromal tumor: report of a case[J]. Surg Today, 2015, 45(2): 247-252.
[11] OZAN E, OZTEKIN O, ALACACIOGLU A, et al. Esophageal gastrointestinalstromal tumor with pulmonary and bone metastases[J]. DiagnIntervRadiol, 2010,16(3):217-220.
[12] PEPARINI N, CARBOTTA G, CHIRLETTI P. Enucleation for gastrointestinalstromal tumors at the esophagogastric junction: is this an adequate solution?[J]. World J Gastroenterol, 2011, 17(16): 2159-2160
[13] TEZCAN Y, KOC M. Gastrointestinal stromal tumor of the rectum withbone and liver metastasis: a case study[J]. Med Oncol, 2011, 28: 204-206.
[14] VON MEHREN M, RANDALL R L, BENJAMIN R S, et al. Soft Tissue Sarcoma,Version 2. 2018, NCCN Clinical Practice Guidelines in Oncology[J]. J Natl ComprCanc Netw, 2018, 16(5): 536-563.
[15] 王超, 高志冬, 申占龙, 等. 腹腔镜手术与开腹手术行食管胃结合部胃肠间质瘤切除的疗效比较[J].中华胃肠外科杂志, 2015(9) : 881-884.





 Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
