青年男性,以发热、腹痛、腹泻1周就诊。患者急性起病,初始考虑感染性肠炎、炎性肠病、肠淋巴瘤等疾病,PET-CT显示多处淋巴结肿大,考虑炎性增生可能,T细胞亚群明显异常,再次复查HIV为阳性,最终明确诊断为艾滋病合并肠损伤。
一、病例介绍
1.患者基本情况
患者:男性,23岁。
入院时间:2018年7月14日。
主诉:发热、腹痛、腹泻1周。
现病史:2018年7月7日,患者白天洗凉水澡后,于晚19时出现发热,无畏寒、寒战,无皮疹,无头痛、头晕,未在意。次日凌晨3时,患者逐渐出现腹痛,伴腹泻3次,多为稀水样便,无黏液脓血便,无便血及黑便,便后腹痛有所缓解,就诊于诊所。经抗病毒、止泻等对症治疗,患者仍间断午后4~5时出现发热,伴恶心、呕吐,最高体温38.6℃。患病以来,患者无胸痛、胸闷,无尿频、尿急、尿痛,精神可,体力差,饮食、睡眠差,体重无明显变化。
既往史:平素健康,否认高血压、糖尿病、冠心病等疾病史,否认肝炎、结核、疟疾等传染病史,否认手术史,否认外伤史,否认输血史,否认食物过敏史,对头孢类药物过敏,预防接种随当地进行。
个人史:生于本溪市,久居于本地。无疫区居住史,无疫源接触史,无放射物、毒物接触史,无毒品接触史;否认冶游史;吸烟9年,每天12~14支;无饮酒史。
基层医院辅助检查:结肠镜及病理学检查见末端回肠炎症改变,多发浅溃疡,伴片状充血、糜烂(图1)。胃镜提示:糜烂性胃炎。
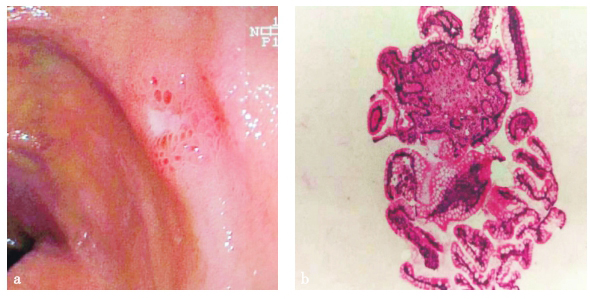
图1 结肠镜镜下及病理结果
a. 结肠镜检查镜下表现;b. 病理结果(HE染色,100×)
血常规:白细胞计数5.5×109/L,中性粒细胞占比88%;粪便常规:隐血阳性;红细胞沉降率(血沉):29mm/第1h末;降钙素原0.10ng/mL;结核抗体、伤寒肥达反应、外斐反应阴性;乙肝、丙肝、梅毒、HIV均为阴性;胸、上腹部CT:肺部未见异常;肝左叶点状高密度灶,考虑肝内胆管结石或钙化。
外院诊断意见及处理:①诊断:腹泻待查,发热待查,回盲部病变待查,糜烂性胃炎。②治疗:给予左氧氟沙星0.5g, q.d.,静脉滴注;蒙脱石散1袋,t.i.d.,口服;奥美拉唑40mg ,q.d.,口服,磷酸铝凝胶1袋, t.i.d.,口服。③疗效:腹泻、发热无明显缓解。
为求进一步诊治,患者来我院就诊。
2.入院查体
一般生命体征:T 38.2℃,P 101次 /min,R 20次/min,BP 111/53mmHg。神志清,查体配合。
阳性体征:咽红,扁桃体未见肿大,咽左侧壁可见1cm×1cm溃疡。上腹部轻压痛。肠鸣音活跃。
3.初步诊断思维过程
(1)腹泻待查
①炎性肠病可能:患者有腹泻、发热症状,肠镜提示回肠末端炎症改变,但无黏液血便,似不支持该诊断。
②感染性肠炎可能:结核抗体阴性,白细胞正常,中性粒细胞偏高,需进一步完善检查予以鉴别。
③其他肠炎可能:如假膜性肠炎、免疫系统疾病、急性胃肠炎。
(2)发热待查
①感染:包括病毒、细菌、真菌、结核分枝杆菌感染等。患者已完成甲型肝炎病毒抗体、乙型肝炎病毒抗体、梅毒螺旋体特异抗体、HIV抗体、结核分枝杆菌抗体检查,需进一步完善丙型肝炎抗体、戊型肝炎抗体、病毒抗体谱、单纯疱疹病毒抗体、肺炎支原体血清学实验等检查。
②结缔组织病:该病可伴发热。患者发病以来,无皮疹,无光过敏,无口干、眼干,无双手遇冷变色,有口腔溃疡,需进一步完善ANA及效价、抗ENA谱等检查。
③肿瘤:患者为青年男性,无明显体重下降,需进一步完善全身淋巴结超声及肿瘤相关检查。
(3)回盲部病变待查
1)克罗恩病:是一种原因不明的肠道炎症性疾病,在胃肠道的任何部位均可发生,但好发于末端回肠和右半结肠。临床表现为腹痛、腹泻、肠梗阻,伴有发热、营养障碍等肠外表现,病程多迁延,反复发作,不易根治。该患者大便性状不典型。
2)肠结核:是结核分枝杆菌(mycobacterium tuberculosis,MTB)引起的肠道慢性特异性感染,主要由人型结核分枝杆菌引起,一般见于中青年人,女性稍多于男性。该患者腹泻、发热,尤其是午后发热的临床症状符合该病特征,但外院查结核抗体阴性。
3)肠淋巴瘤:肠恶性淋巴瘤包括原发于肠道的结外淋巴瘤及其他部位恶性淋巴瘤累及胃肠道的继发性病变。原发者起病隐匿,早期缺乏特异性。该病好发于淋巴组织较丰富的回肠末端和盲肠,其次为右半结肠,分布可以呈局限性,但一般较癌累及范围广。该病例需完善全身检查予以排除。
4)其他:小肠腺癌?
(4)糜烂性胃炎
4.后续检查
血常规:白细胞计数5.8×109/L,中性粒细胞占比50.3%,血小板计数166×109/L,红细胞计数4.79×1012/L,血红蛋白163g/L。
尿常规:隐血(±)。
粪便常规:隐血阳性,转铁蛋白阳性。粪便涂片:革兰阳性球菌∶革兰阴性杆菌为1∶4。粪便腺病毒、轮状病毒阴性,寄生虫虫卵检查阴性。
肝功能:血清γ-谷氨酰转肽酶81.01U/L,血清丙氨酸氨基转移酶329.62U/L,血清总胆红素4.7μmol/L,血清天冬氨酸氨基转移酶246.97U/L。
血清离子钠钾氯钙检查(E4A):血清钠136.0mmol/L,血清钾3.49mmol/L,血二氧化碳总量18.9mmol/L,血清氯107.1mmol/L。
心肌酶谱+同工酶:血清乳酸脱氢酶692U/L,超敏C反应蛋白12.0mg/L,血清磷酸肌酸激酶83U/L,血清磷酸肌酸激酶同工酶17U/L。
肾功能:血清肌酐83.40μmol/L,血清尿素3.15mmol/L。
葡萄糖定量试验5.55mmol/L,糖化血红蛋白6.00%。
血脂:血清总胆固醇3.57mmol/L,血清高密度脂蛋白0.93mmol/L,血清甘油三酯1.75mmol/L,血清低密度脂蛋白2.31mmol/L。
乙肝、丙肝、梅毒、HIV相关检查均为阴性,自身免疫性肝病系列未见异常,甲肝、戊肝相关检查阴性。
凝血:纤维蛋白原4.59g/L,D-二聚体2.07mg/L。
结核分枝杆菌抗体阴性,甲状腺功能五项(游离三碘甲状腺原氨酸、游离甲状腺素、促甲状腺激素、甲状腺球蛋白自身抗体、甲状腺过氧化物酶自身抗体)阴性,铁蛋白1167.5ng/mL,血清免疫球蛋白E187.3IU/mL(↑)。革兰阴性菌脂多糖检测(血液)0.03EU/mL,真菌(1-3)-β-D葡聚糖定量检测[G]37.5pg/mL。
免疫监测未见异常。
风湿检测:血清免疫球蛋白A 3.29g/L,抗链球菌溶血素O(antistreptolysin O,ASO)311.1U/mL(↑);抗核抗体、抗双链DNA抗体、抗U1核糖核蛋白抗体、抗SmD1抗体、抗SS-A/Ro60KD抗体、抗Sc170抗体、抗Jo-1抗体阴性、PANCA阴性。
C- 反应蛋白 10.8mg/L(↑)。
病毒谱检查:肺炎支原体抗体IgM弱阳性(↓),EB病毒核抗原抗体IgG-NA阳性(↑),EB壳抗原IgG抗体高亲和力阳性(↑),EB病毒衣壳抗原抗体IgG-CA阳性(↑);巨细胞病毒核酸定量检测<4.0×102copies/mL;弓形虫IGM抗体阴性AU/ML;单纯疱疹病毒I型IgG抗体阳性;风疹病毒IgG抗体阳性;巨细胞病毒IgG抗体阳性;风疹病毒IgG抗体阳性。
痰一般细菌培养:革兰阳性球菌++++(大量),革兰阳性杆菌+++(中等量),鳞状上皮细胞>25个/低倍镜,多形核白细胞>25个/低倍镜,革兰阴性杆菌++(少量)。
超声:双侧颈部及腹股沟区淋巴结稍增大。心内结构及彩色血流未见明显异常。
头、胸、全腹CT:肝左内叶钙化灶;腹腔及腹膜后淋巴结增大;双侧颈部、锁骨上、双腋窝、双腹股沟区淋巴结;头部未见异常(图2)。
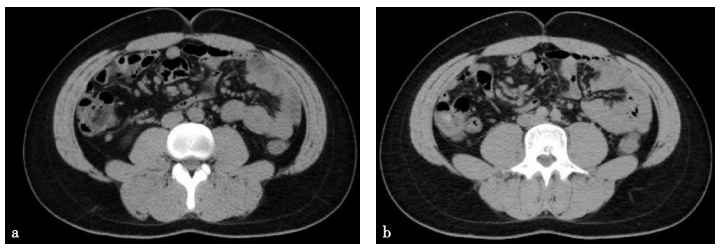
图2 CT检查
全消化道造影:提示胃、十二指肠炎。
5.最终诊疗思维过程
诊断:腹泻原因待查?发热原因待查?回肠末端溃疡性质待定?糜烂性胃炎,肝功能不全,电解质紊乱(低钾、低钠血症)。
处置:地衣芽孢杆菌调节肠道菌群,蒙脱石散止泻,云南白药治疗大便隐血,多烯磷脂胆碱保肝,纠正电解质紊乱,化痰,退热及营养支持治疗。进一步完善血培养、粪便培养、痰培养检查;拟行小肠镜及全身PET-CT检查;复查异常结果。
6.后续检查
多次大便培养提示金黄色葡萄球菌,经临床药师会诊,给予万古霉素口服。多次血培养仅1次有革兰阳性球菌,多次痰培养仅1次有革兰阳性球菌,考虑标本污染可能性大。
经肛小肠镜检查提示回肠见多发散在小溃疡(图3);取活检病理提示溃疡部组织伴腺体上皮细胞增生活跃。
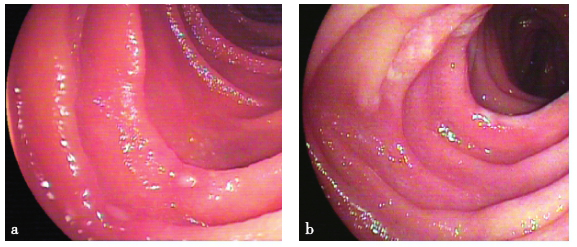
图3 小肠镜检查
完善全身PET-CT:双侧颈部、左侧锁骨上窝、左侧腋下、双侧肺门、纵隔、腹腔、腹膜后、双侧盆壁、双侧腹股沟多发淋巴结增大,代谢增高,考虑淋巴结炎性增生可能性。双侧扁桃体炎可能性大。双侧骶髂关节炎。直肠、结肠代谢弥漫性增高,管壁弥漫性增厚,考虑炎性病变可能性大。脾脏略增大,代谢增高,考虑炎性改变可能性大。肝脏S4段钙化灶。左肺陈旧性病变。左侧筛窦炎。余部未见明显异常代谢。
患者反复发热,多处淋巴结肿大,查T细胞亚群异常:辅助/诱导淋巴细胞百分比(CD3+/CD4+)16.6%(↓);T辅助细胞:T抑制细胞(CD4/CD8)0.25(↓);总T淋巴细胞百分比(CD3+)84.4%(↑);T 抑制/毒性淋巴细胞百分比(CD3+/CD8+)65.9%(↑)。
再次复查HIV抗体:可疑阳性。
7.最终诊断
艾滋病肠损伤。根据患者间隔4周的两次艾滋病抗体检测结果,最终于2018年8月19日抽血检查,诊断为艾滋病病毒抗体阳性。
8.后续治疗
①调节肠道菌群;②止泻;③保肝对症;④传染病上报,转感染专科就诊。
9.转院时情况
(1)症状
腹泻缓解,排黄色软便1~2次/d;发热缓解,体温最高37.5℃,发热时间缩短。
(2)复查检查
粪便隐血阴性,肝功能正常。
10.出院随访
患者于疾控中心对症治疗,腹泻症状间断反复。
二、疾病诊疗难点
1.艾滋病窗口期的诊断
即使采取目前最先进的艾滋病检测技术(第三、四代双原夹心法和酶联法以及化学发光法等检测手段),艾滋病的窗口期也需要14~21天。患者刻意隐瞒冶游史,入院前相关化验检查HIV阴性,且肠镜提示黏膜炎症表现,使诊断一度倾向于炎性肠病、肠结核、肠淋巴瘤等方向,增加了诊断难度。
2.腹泻、发热原因多样化
该病例主要症状为腹泻、发热,临床可以引起这两种症状的原因很多,大部分肠道疾病均可出现,还可能由伤寒、风湿、败血症、内分泌及代谢障碍疾病、神经功能紊乱、药物副作用、中毒、过敏、消化系统其他脏器疾病等引起,增加了诊断分析的难度。
三、疾病知识回顾
1.讨论
艾滋病(AIDS)是人类免疫缺陷病毒(HIV)感染引起的,是威胁着人类健康的重大疾病之一。HIV/AIDS涉及宿主免疫系统、神经系统等多个器官系统的各种组织,但是黏膜组织在HIV/AIDS的自然发生过程中起着十分关键的作用。肠道黏膜是覆盖面积最大的黏膜组织,含有体内大部分的免疫细胞,是包括HIV-1在内的绝大多数病原因子入侵机体的门户,也是HIV感染的主要靶组织。
自AIDS流行伊始,人们就注意到HIV/AIDS患者的肠道功能异常。虽然最初关注的主要是肠道消化、吸收和分泌功能异常,但也已注意到肠道屏障功能的异常改变,如许多AIDS患者出现腹泻。随后的研究证实,HIV感染对肠道结构和免疫系统的损伤在AIDS疾病进展中具有不可忽视的作用。HIV感染对肠道黏膜获得性免疫成分影响的显著标志是肠黏膜CD4+T淋巴细胞在感染2~3周内大量耗损。在HIV感染者中,肠道巨噬细胞可以被HIV感染;HIV感染还可影响肠黏膜中树突状细胞的功能和丰度;HIV感染后,固有淋巴样细胞的数量和功能也出现异常;肠道黏膜中的自然杀伤(NK)细胞在HIV感染慢性期显著减少。这些均导致肠道黏膜免疫功能的损伤,从而出现肠道及全身症状。
肠道上皮物理屏障损伤和紧密连接异常是HIV/AIDS患者中的常见现象。在AIDS发现初期,人们就发现肠道黏膜的通透性发生了变化。HIV/AIDS患者中有高达40%左右的腹泻患者无可鉴定的致腹泻病原,可能与肠道上皮屏障缺陷相关。肠道上皮紧密连接在HIV感染后也发生显著变化。体外研究发现,HIV蛋白(如HIV-1gpl20)可以改变肠道上皮细胞紧密连接蛋白的表达和分布。
此外,HIV感染对肠道微生态产生显著影响。近年研究表明,虽然总的微生物水平和多样性在HIV感染组与未感染组之间没有显著差异,但感染组的微生物组出现了明显的变化:变形菌,尤其是肠杆菌科细菌,包括沙门菌、埃希菌、志贺菌等在HIV感染组肠道中更为丰富,而拟杆菌(Bacteroides)和另枝菌则变少。
总之,HIV感染对肠道的影响是明确存在的,需要医师在临床诊治中充分考虑,避免误诊,并及时、反复完善相关检查,予以鉴别诊断。
2.治疗方法
修复黏膜屏障、抑制微生物移位、抑制系统免疫活化等方法已开始应用于HIV/AIDS的治疗尝试,临床前动物实验和临床试验均有报道。已有多个研究组报道了利用益生菌改善HIV感染者肠道功能的研究结果。最近一个双盲随机安慰剂对照临床试验表明:用食用酵母菌处理12周可以显著减少HIV感染者体内微生物移位,并降低炎症水平,其效果在停止处理后3个月仍存在。
3.诊疗体会
腹泻及发热的原因多样,即使少见原因的检查呈阴性,仍需注意其窗口期,定期复查,以获得更有价值的诊断线索,及早对因治疗。这个病例最关键的反转在于复查HIV抗体。但并不是每个医师都会想到重复去查HIV抗体,建议作者能介绍什么样的线索使得医师即使在HIV抗体首次阴性的情况下仍去考虑复查,比如,对于什么样的患者医师会考虑去查T细胞亚群,在不知道HIV抗体复查结果的情况下,如何排除其他疾病可能而锁定感染性疾病,患者的哪些行为特征或体征会让医师倾向于怀疑AIDS。这是该案例最有意义的启示。
专家点评
患者为青年男性,以发热、腹痛、腹泻1周就诊。患者急性起病,初始考虑感染性肠炎、炎性肠病、肠淋巴瘤等疾病,PET-CT显示多处淋巴结肿大,考虑炎性增生可能,T细胞亚群明显异常,再次复查HIV为阳性,最终明确诊断为艾滋病合并肠损伤。该病例初期诊断较为困难,原因在于患者隐瞒了相关病史。但最终得以明确诊断,也反映了该病例的经治医师具有很好的临床思维。
目前,艾滋病在临床并不少见。相关的病史询问和获得有助于诊断,及时行HIV检查可明确诊断。当临床上难以用其他疾病解释患者症状时,应警惕AIDS病可能。
免责声明
内容来源于人卫知识数字服务体系、人卫inside知识库,其观点不反映优医迈或默沙东观点。此服务由优医迈与胤迈医药科技(上海)有限公司授权共同提供。
如需转载,请前往用户反馈页面提交说明:https://www.uemeds.cn/personal/feedback
[1]ROYCE R A,SEFIA A,CATES W,et al. Sexual transmission of HIV[J]. N Eng J Med, 1997, 336: 1072-1078.
[2]KOTLER D P,GAETZ H P,LANGE M,et al. Enteropathy associated with the acquired immunodeficiency syndrome[J]. Ann Intern Med, 1984, 101: 421-442.
[3]BRENCHLEY J M,SCHACKER T W,RUFF L E,et al. CD4+ T cell depletion during all stages of HIV disease occurs predominantly in the gastrointestinal tract[J]. J ExpMed, 2004, 200: 749-759.
[4]MOORE A,BIXLER S L,LEWIS M G,et al. Mucosal and peripheral Lin-HLA-DR+CD11c/123-CD13+CD14-mononuclear cells are preferentially infected during acute simian immunodeficiency virus infection[J]. J Virof, 2012, 86: 1069-1078.
[5]LEHMANN C,JUNG N,FORSTER K,et al. Longitudinal analysis of distribution and function of plasmacytoid dendritic cells in peripheral blood and gut mucosa of HIV infected patients[J]. J Infect Dis, 2014, 209: 940-949.
[6]EPPLE H J,SCHNEIDER T,TROEGER H,et al. Impairment of the intestinal barrier is evident in untreated but absent in suppressively treated HIV-infected patients[J]. Gut, 2009, 58(2): 220-227.
[7]COLEBUNDERS R,LUSAKUMUNI K,NELSON A M,et al. Persistent diarrhoea in Zairian AIDS patients:an endoscopic and histological study[J]. Gut,1988, 29(12): 1687-1691.
[8]STOCKMANN M,FROMM M,SCHMITZ H,et al. Duodenal biopsies of HIV-infected patients with diarrhoea exhibit epithelial barrier defects but no active secretion[J]. AIDS, 1998, 12(1): 43-51.
[9]CHUNG C Y,ALDENlSL,FUNDERBURG N T,et al. Progressive proximal-to-distal reduction in expression of the tight junction complex in colonic epithelium of virally-suppressed HIV+individuals[J]. PLoS Pathog, 2014, 10(6): e1004198.
[10]NEFF C P,KRUEGER O,XIONG K,et al. Fecal microbiota composition drives immune activation in HIV-infected individuals[J]. Ebio Medicine, 2018, 30: 192-202.
[11]ROUTY J P,MEHRAJ V. Potential contribution of gut microbiota and systemic inflammation on HIV vaccine effectiveness and vaccine design[J]. AIDS Res Ther,2017,14(1): 48.
[12]DINH D M,VOLPE G E,DUFFALO C,et al. Intestinal microbiota,microbial translocation,and systemic inflammation in chronic HIV infection[J]. J Infect Dis, 2015, 211(1): 19-27.
[13]VUJKOVIC-CVIJIN I,DUNHAM R M,IWAI S,et al. Dysbiosis of the gut microbiota is associated with HIV disease progression and tryptophan catabolism[J]. Sci Transl Med, 2013, 5(193): 193ra91.
[14]ROUTY J P,ANGELJB,PATEL M,et al. Assessment of chloroquine as a modulator of immune activation to improve CD4 recovery in immune nonresponding HIV-infected patients receiving antiretroviral therapy[J]. HIV Med, 2015, 16(1): 48-56.
[15]VILLAR-GARCÍA J,GÜERRI-FERNÁNDEZ R,MOYA A,et al. Impact of probiotic Saccharomyces boulardii on the gut microbiome composition in HIV-treated patients:A double-blind,randomised,placebo-controlled trial[J]. PLoS One, 2017, 12(4): e0173802.
[16]WILSON N L,MONEYHAM L D,ALEXANDROV A W. A systematic review of probiotics as a potential intervention to restore gut health in HIV infection[J]. J Assoc Nurses AIDS Care, 2013, 24(2): 98-111.
[17]D ANGELO C,REALE M,COSTANTINI E. Microbiota and probiotics in health and HIV infection[J]. Nutrients,2017, 9(6): E615.
人卫知识数字服务体系





 Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.