中央型肺癌是指发生于肺段及肺段以上较大支气管黏膜上皮或腺体的恶性肿瘤。病理上早期中央型肺癌是指病变局限于管壁或管腔内,尚未突破管壁。主要表现为支气管腔局限性狭窄,狭窄远端发展为梗阻或突然截断。在狭窄、梗阻部位的支气管管壁有不规则增厚并常形成明显肺门肿块,还可形成癌性淋巴管炎。
中央型肺癌组织病理学上一般分为4型:鳞状细胞癌、腺癌、小细胞癌、大细胞未分化癌。鳞状细胞癌最常见,其次为腺癌和小细胞癌。
【临床表现】
早期中央型肺癌可无任何症状,典型症状则为刺激性干咳,但通常的症状则是一般的呼吸道症状如咳嗽、咳痰,可伴有断断续续的痰中带血,合并阻塞性炎症时可出现感染症状,反复同一部位的炎症应警惕存在肺癌。
中晚期中央型肺癌常见呼吸道症状如咳嗽、咳痰,并常可伴有痰中带血,甚至大口咯血;合并阻塞性炎症时出现感染症状;侵犯纵隔内、气管旁淋巴结压迫上腔静脉引起上腔静脉综合征;侵犯喉返神经有声嘶,侵犯神经有膈肌麻痹和气急;肺外副肿瘤综合征,即由肿瘤引起的一系列异位激素性和代谢性症状综合征,包括肿瘤的异位内分泌症状、过多分泌5-羟色胺引起的类癌综合征及肺性骨关节病等。
【影像检查技术与优选】
中央型肺癌的主要影像学检查方法有X线胸片、CT、MRI以及PET-CT等。首选检查方法是胸部X线正侧位;发现病变后做CT检查,未发现病变但临床症状持续时也需要做CT检查。PET-CT在肺癌的影像诊断和分期方面具有最高的特异性和准确性,对CT不能肯定诊断的病例有重要价值,是CT检查之后的重要补充。MRI有其特点,可作为补充手段。
目前“胸部X线片-CT和/或PET/CT”这一检查思路是主流,其中CT检查是最佳的无创检查方法,其敏感性和特异性均较高。在常规CT扫描的基础上薄层重建,有助于发现支气管壁的增厚和支气管腔内结节。
早期中央型肺癌有些病灶紧邻血管或者肺门淋巴结,CT平扫不易被发现,通过增强扫描并薄层重建后,对图像进行多平面重组(MPR)和仿真支气管镜(CTVB)处理,可以更好地显示病灶与气管、血管的关系,使早期中央型肺癌的检出率和诊断正确率明显提高,但确诊一般需要行支气管镜检查和镜下活检。
【影像学表现】
(一)早期中央型肺癌
1.X线表现
早期中央型肺癌X线片可能没有任何异常表现。常见的阳性征象为支气管狭窄、阻塞引起的阻塞性肺气肿、肺炎、肺不张。肺叶、肺段性肺气肿常常为早期中央型肺癌的唯一征象,表现为局限性肺透光度增高,以呼气相明显。阻塞性肺炎表现为肿瘤支气管所属肺叶、段的斑点状、斑片状及索条状阴影。支气管完全阻塞后出现肺不张,表现为类楔形、类三角形致密阴影,邻近叶间裂向病变移位,亦可表现为一侧肺不张,伴纵隔向患侧移位。
2.CT表现
(1)原位癌:癌组织主要位于支气管黏膜上皮内,支气管管壁无明显增厚。管腔内无明确的隆起改变,有时可见支气管内表面稍隆起、毛糙或呈细颗粒状改变,因此CT诊断价值有限,CTVB可能显示支气管内壁的粗糙等改变,其确诊有赖于支气管镜。
(2)管内型:CT轴位及MPR图像可见管腔内的菜花状、息肉样隆起,同时可显示病灶的纵向范围及管腔狭窄。增强后管腔内隆起性病变强化,可伴有支气管壁的局限性增厚。minIP显示低密度的含气支气管内高密度的肿块或结节影,VR图像上可见气管、支气管一侧壁的弧形、半球形或不规则形缺损;CTVB可见支气管腔的阻塞或局限性隆起,表面光整或凹凸不平(图1)。支气管不完全性阻塞可出现肺叶、肺段的透光度增加,叶间裂膨隆;阻塞进一步发展。在病变支气管所属的肺叶、肺段,见斑片状模糊阴影,甚至肺叶、肺段的实变。支气管完全阻塞可致肺叶、肺段的不张。
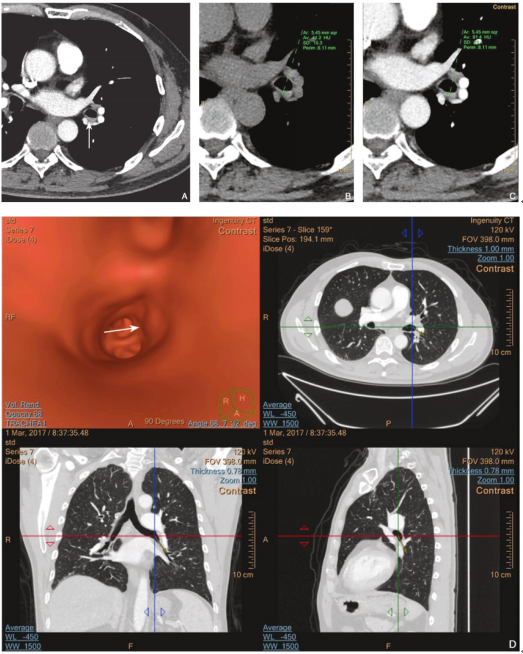
图1 支气管鳞状上皮高级别上皮内瘤变,局部癌变
男性,53岁,因右肺中叶肿块拟行右肺中叶切除术时,术前支气管镜检查发现左肺下叶基底段与背段间隆嵴上新生物,增强扫描纵隔窗(A)示左肺下叶基底段与背段间隆嵴黏膜增厚(箭),平扫(B)和增强扫描(C)纵隔窗对比,黏膜增厚处测量CT净增值为40HU;仿真内镜后处理(D)示病变处黏膜隆起(箭)
(3)管壁浸润型:CT轴位及MPR重建可显示支气管壁的局限性、不规则性增厚,有时增厚可以沿支气管长轴侵及较大范围,可以伴有程度不同的腔内隆起。增强扫描动脉图像可更好地显示支气管壁的增厚情况,有利于区分支气管壁的增厚和伴行的血管影(图2)。MinIP、VR图像可见支气管偏心性或对称性狭窄,当支气管狭窄明显时可见病变支气管相应肺叶、肺段的阻塞性肺气肿,阻塞性肺炎及肺不张等改变。
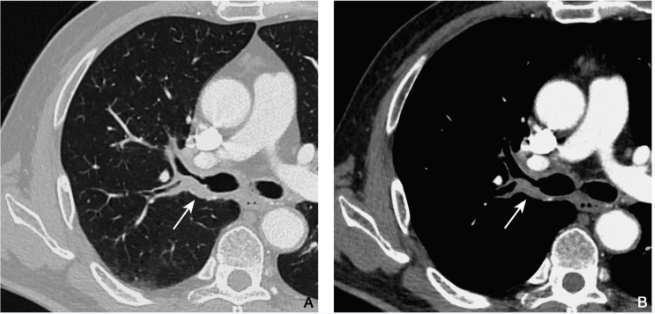
图2 浸润性鳞癌
男性,69岁,咳嗽伴痰中带血1个月就诊,术前增强CT肺窗(A)及纵隔窗(B)示右肺上叶支气管管壁增厚(箭),以支气管后壁为著
(二)中晚期中央型肺癌
1.X线表现
出现肺门肿块提示为中晚期,阻塞性肺部改变是X线片上重要的辅助征象。阻塞性肺不张表现为叶间裂或周围结构包括纵隔、膈肌及胸壁等的移位;如果有明显的肺门肿块形成,则此肺门突出的肿块阴影与不张肺的边缘构成X线上典型的反“S”征或Golden征(图3A)。胸片由于是前后投照成像,图像有重叠,显示病灶细节的能力有限。
随着胸部CT扫描在临床上广泛应用,目前胸部X线检查仅用于检出病灶,病灶定性诊断有赖于CT检查。本节重点描述CT征象。
2.CT表现
(1)直接征象:表现为支气管管壁增厚,管腔狭窄、阻塞以及肺门肿块(图3、4)。位于肺叶支气管周围的肺门肿块多为管壁型肿块,表现为支气管管壁局限性增厚、伴支气管周围的软组织肿块,可伴有管腔的狭窄、阻塞(图3)。位于肺段支气管周围的肿块多为管外型肿块,肿瘤常沿肺段支气管长轴生长,可侵及整个肺段,类似于肺实变,但边缘往往膨隆、有分叶或切迹。
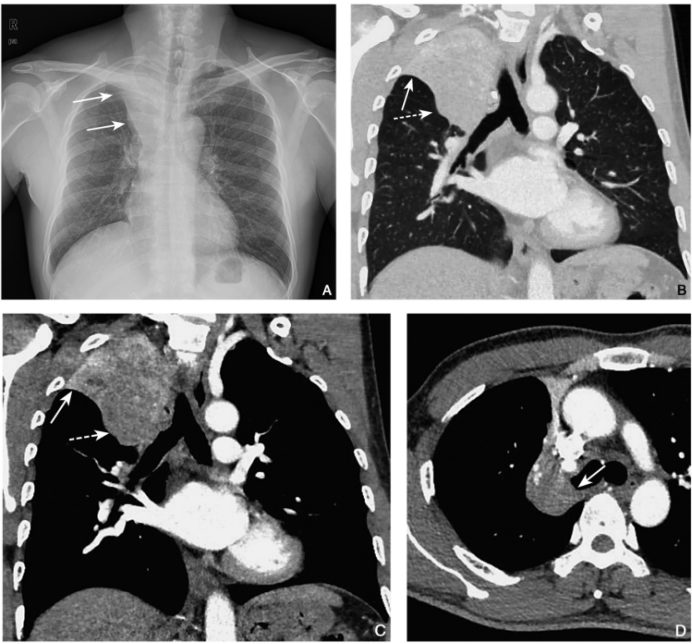
图3 鳞状细胞癌
男性,56岁,体检发现右肺上叶占位,胸部X线片(A)示右上肺门见肿块影,远段肺组织实变,边缘呈反“S”征(实箭),胸部CT冠状位肺窗(B)示右肺上叶肺门处肿块(虚箭)及远段肺组织实变(实箭),增强扫描动脉期冠状位纵隔窗(C)更清晰显示右肺上叶肺门处肿块(虚箭)及远段肺组织不张(实箭),横断位增强扫描(D)示右主支气管管腔内见软组织密度影(实箭)
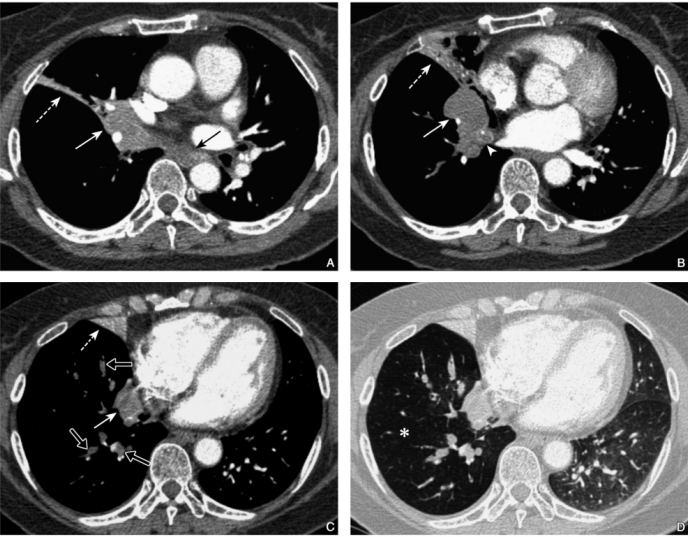
图4 鳞状细胞癌
女性,67岁,胸部CT示右肺中叶、下叶肺门处不规则肿块影(A、B、C白实箭),纵隔淋巴结肿大(A黑箭),右肺中间段支气管局部管腔闭塞(B箭头),右肺中叶肺组织不张(A、B、C白虚箭),右肺下叶支气管内见黏液嵌塞(C空心箭),右肺下叶肺密度较左肺减低,为阻塞性肺局限性过度充气(星号)
支气管狭窄范围较局限,管腔不规则。支气管梗阻常合并管腔狭窄或截断,断端表现为平直、杯口状或锥状。支气管管壁在狭窄、梗阻部位常有不规则增厚,伴有腔内软组织结节。肺门肿块外缘较为光滑清楚,可有浅分叶,密度均匀或不均匀。有的肿块内有钙化,多为肺癌发生之前肺门淋巴结原有的钙化,亦可为肿瘤本身的营养不良性钙化。
(2)间接征象
1)阻塞性肺气肿:呈现为肺段、肺叶范围的密度减低区(图4D)。
2)阻塞性肺炎:因支气管阻塞程度和时间不同表现为小叶融合、肺段、肺叶实变影像。小叶融合实变表现为斑片状模糊阴影(图5A),常合并支气管血管束增粗、模糊。肺段、肺叶实变表现为肺段、肺叶范围的楔形密度增高影,因常合并肺不张,肺体积往往缩小,实变病灶的肺门侧密度增高,边缘往往膨隆,可有分叶,此点与一般的大叶性肺炎不同。病灶内可有支气管充气征,当肿瘤向远侧侵犯时,充气支气管分支减少、僵硬。增强后实变病灶内部可见强化的血管影,即“血管造影征”(图5C),并可见边界清楚的坏死区。
3)阻塞性肺不张:指肿瘤所在支气管相应的肺段、肺叶体积减小,密度增高,肺门侧有肿块影突出于肺不张的边缘。增强扫描后不张肺内可见肿块轮廓,其强化幅度低于不张的肺组织(图3C,4~6)。增强扫描在实变肺组织及不张肺内可见“黏液支气管征”,为支气管内潴留的黏液,与扫描层面平行的支气管分支呈条状低密度影,与扫描层面垂直的支气管为类圆形低密度影(图4C、6E)。“黏液支气管征”的发生机制为支气管阻塞时黏液腺持续分泌黏液,直至支气管管腔内压超过分泌压,黏液通过支气管黏膜纤毛运动传递到梗阻部位,形成“指套征”影像。
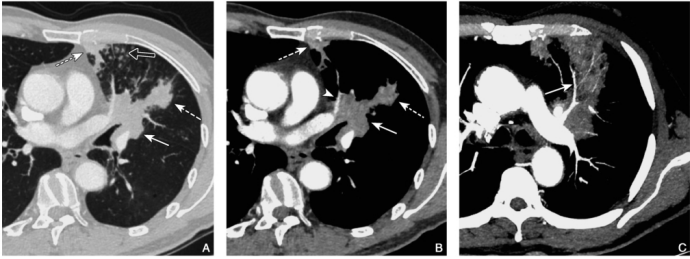
图5 鳞状细胞癌
男性,65岁,胸部CT肺窗(A)及其纵隔窗(B)示左肺上叶舌段支气管管壁增厚伴软组织肿块形成(实箭),远段肺组织见片状实变影(虚箭)及斑片影(空心箭),为阻塞性肺不张(虚箭)和阻塞性肺炎(空心箭),肿块侵犯左肺上叶肺血管(箭头)。最大密度投影重建图(C)显示左肺上叶实变的病灶内见强化的血管影,即“血管造影征”(C实箭)
(3)转移表现:胸内淋巴结转移表现为肺门、纵隔淋巴结增大(图4A)。淋巴结转移可发生于任何一组,以气管前腔静脉后,主肺动脉窗,隆嵴下。主动脉弓旁及双肺门多见。转移性淋巴结可以单发,亦可融合。增强后肿大淋巴结呈轻至中度强化,以均匀性强化多见。肺内结节、胸膜结节及胸腔积液多见于血行转移。胸部增强扫描或CT血管造影(CTA)有助于显示肿瘤对肺动脉、肺静脉、上腔静脉及心脏房室的侵犯(图5B)。
3.MRI表现
MRI可显示支气管壁增厚、管腔狭窄及腔内结节。MRI有助于区分阻塞性肺不张内的肺门肿块,T2WI肺不张信号与肿瘤有差异,且增强后肺不张强化较肿瘤明显(图7)。MRI还可以区别肺肿瘤与肿瘤放疗后的纤维化,肺癌表现为长T1、长T2信号,而纤维化在 T1WI、T2WI上均为低信号。
MRI上,正常纵隔大血管、气管和支气管周围常有一层高信号脂肪带,且血管因流空效应而呈黑影,与肿瘤很容易区分,从而有助于显示肺癌对心脏大血管的侵犯。另外,MRI较易显示肿瘤对胸壁、肋骨的侵犯及纵隔、肺门淋巴结肿大。对于肺癌的分期尤为重要。

图6 肺癌
男性,71岁,咳嗽、咳痰并痰中带血1个月余就诊。胸部CT示左肺主支气管管腔内见软组织密度影(A、B),肿块沿管壁浸润(D),伴远端肺组织阻塞性不张、阻塞性肺炎(C),左肺上叶舌段支气管内见黏液嵌塞,见“黏液支气管征”(E),支气管镜示左肺主支气管远端见新生物生长(F,白箭)
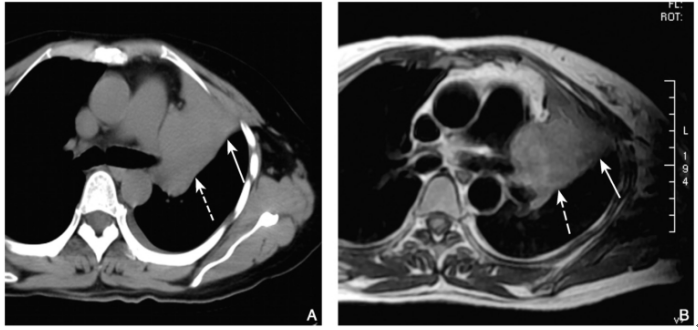
图7 肺癌
胸部CT纵隔窗(A)示左肺上叶肺门肿块与其远段肺组织实变分界不清,MR扫描DOUBLEIR序列(B)可清晰显示肿块(虚箭)与肺不张(实箭)的分界
【诊断依据】
中央型肺癌诊断的关键是中央支气管即叶段和主支气管的管壁增厚、管腔狭窄;早期中央型肺癌的关键征象是病变尚未突破管壁。胸片显示中央型肺癌比较困难,通常只能看到间接征象即阻塞性改变,直接征象会被掩盖,如果有明显的肺门肿块形成,则此肺门突出的肿块阴影与不张肺的边缘构成X线上典型的反“S”征或Golden征。
CT可以充分显示早期中央型肺癌的支气管病变,表现为宽基底的腔内结节(呈微小凸起或明显的菜花样或息肉状)、支气管管壁局限性不规则增厚、管腔环形或偏心性狭窄甚至闭塞,但没有腔外侵犯和肿块。出现肺门肿块提示为中晚期,CT可以很好地显示各种形态的支气管病变及其周围的软组织肿块。受累支气管表现为管壁局限性不规则增厚、管腔环形或偏心性狭窄甚至闭塞;闭塞可为渐进性漏斗状或偏心性逐渐阻塞,也可为管腔突然截断,断端平直或呈反杯口状。癌组织直接侵犯肺实质形成团块,并可以侵犯或压迫邻近的肺血管,导致血管腔结构变形、狭窄、形态不规则,甚至中断。
肺门及纵隔淋巴结转移表现为肿大、融合、坏死等。MRI对中央型肺癌的表现和诊断基本同CT,在区分肺门肿块与不张肺组织,显示淋巴结、血管等方面优于CT,但空间分辨率不及CT,对一些细小病变显示不佳。
【鉴别诊断】
1.支气管内膜结核
支气管内膜结核影像上可以表现为支气管的狭窄、管壁的增厚,与中央型肺癌有时鉴别困难。根据病理及影像表现,支气管内膜结核可分为以下表现。
(1)支气管狭窄型:最常见,为黏膜或黏膜下结核分枝杆菌浸润导致黏膜充血、水肿、淋巴细胞浸润,进而黏膜发生干酪样坏死、溃疡及肉芽组织形成,进一步发展为纤维增生、管腔的狭窄。CT表现为支气管管腔广泛不规则狭窄,有时狭窄与扩张断续分布,呈串珠状改变,支气管内壁毛糙,管腔内常有黏液样分泌物。而中央型肺癌的支气管往往表现为局限性杯口状或鼠尾状狭窄或截断。
(2)支气管管壁增厚型:支气管邻近的结核病灶浸润支气管外膜、纤维软骨引起支气管壁的增厚,亦可为黏膜下结核分枝杆菌向外侵犯导致支气管壁的全层增厚。CT表现为支气管僵硬、管壁明显增厚,管腔内表面凹凸不平,常伴有支气管壁或支气管周围的斑点状钙化。
(3)肺不张型:支气管病变进展或干酪物质脱落可以导致管腔闭塞,使得相应肺叶通气不良,肺组织萎陷、不张。CT表现为阻塞支气管远端肺叶的实变、不张,叶间裂移位。实变或不张病灶内可见“支气管充气征”或指套样的黏液嵌塞。支气管结核引起的肺不张为可复性,即有干酪物质堵塞支气管时所属肺叶时发生不张,而干酪物质排出后肺组织可以复张。另外,在病变所辖肺叶或邻近其他肺叶,可以有斑点状、斑片状以及粟粒样的播散病灶。支气管阻塞处往往无软组织肿块,不同于中央型肺癌,鉴别诊断需要结合临床症状、痰培养、结核抗体测定等实验室检查,必要时可行支气管镜检查协助诊断。
2.支气管良性肿瘤
发生于支气管的良性肿瘤少见,包括错构瘤、腺瘤等。发生于肺段支气管者多表现为支气管梗阻,发生于肺叶支气管或主支气管者可表现支气管梗阻或支气管腔内结节,无邻近支气管壁的增厚。多层螺旋CT薄层重建可见瘤内成分。纵隔内一般无肿大淋巴结。临床病史较长,与中央型鳞癌不难鉴别,但与类癌、黏液表皮样癌等难以鉴别。
3.支气管内转移瘤
源自肺外肿瘤的气管或支气管内转移罕见,其发生率取决于支气管内转移瘤的定义。狭义支气管内转移瘤指肺外恶性肿瘤直接转移至支气管壁而形成结节样腔内肿块。广义的支气管内转移瘤包括肺外肿瘤直接转移至支气管壁、肺实质转移灶侵犯支气管、肺门或纵隔淋巴结转移侵及支气管、周围型转移瘤沿近侧支气管蔓延等。
广义支气管内转移瘤的发生率高达25%~50%,而狭义支气管内转移瘤发生率为1%~2%。支气管内转移瘤的影像学表现多样,可呈管腔内肿块、支气管壁局限性增厚或肺门肿块,可伴阻塞性肺气肿。肺炎、肺不张,需结合原发肿瘤病史。
4.支气管淀粉样变
支气管淀粉样变是全身性疾病的一部分,也可以局限于气道和肺组织(原发性肺淀粉样变性)。病理特征是异常的淀粉样物质沉积于细胞外组织。表现形式包括弥漫性肺间质性改变、单发或多发肺结节或气管、支气管黏膜下沉积。气管、支气管黏膜下沉积最常见,典型表现为支气管腔内结节和管腔的不规则狭窄,黏膜下线形钙化或骨化具有鉴别诊断意义。
5.复发性多软骨炎
复发性多软骨炎是一种罕见的自身免疫综合征,特征是反复发作的软骨炎,继而引起软骨变性、结构消失和纤维化。病变可累及耳、鼻、周围关节、喉以及气管支气管树软骨。喉、气管及支气管受累见于10%的患者,但所有患者中有50%的患者最终出现气管、支气管侵犯。影像上表现为弥漫性或局灶性气道改变,喉和气管上部最常受累,亦可累及亚段支气管,气管壁增厚伴软骨环破坏,但气管后部的膜部正常,呼气期间动态CT扫描可见气道明显塌陷。
参考文献
1.Chen W,Zheng R,Baade PD,et al. Cancer Statistics in China,2015[J].CA Cancer J Clin,2016,66:115-132.
2.Bray F,Ferlay J,Soerjomataram I,et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CACancer J clin,2018,68:394-424.
3.National Lung Screening Trial Research Team,Aberle D,Adams AM,et al. Reduced lung-cancer mortality with low-dose computed tomographic screening[J].N Engl J Med,2011,365:395-409.
4.Wood DE,Kazerooni EA,Baum SL,et al. Lung Cancer Screening,Version 3.2018,NCCN Clinical Pratice Guidelines in Oncology[J].J Nati Compr Canc Netw,2018,16:412-441.
5.中华医学会放射学分会心胸学组.低剂量螺旋CT肺癌筛查专家共识[J].中华放射学杂志,2015,49:328-335.
6.赵世俊,吴宁.低剂量螺旋CT肺癌筛查:从研究走向应用[J].中华健康管理学杂志,2015,9:244-249.
7.Oudkerk M,Devaraj A,Vliegenthart R,et al. European position statement on lung cancer screening[J].Lancet Oncology,2017,18:e754-e766.
8.中华医学会放射学分会心胸学组.肺亚实性结节影像处理专家共识[J].中华放射学杂志,2015,49:254-258.
9.MacMahon H,Naidich DP,Goo JM,et al. Guidelines for management of incidental pulmonary nodules detected on CT images:from the Fleischner society 2017[J].Radiology,2017,284:228-243.
10.American College of Radiology. Lung CT screening reporting and data system (Lung-RADS)[2014-07-31].http:/www.acr.org/Quality-Safety/Resources/LungRADS.
11.Manos D,Seely JM,Taylor J,et al. The lung reporting and data system (LU-RADS):a proposal for computed tomography screening[J].Can Assoc Radiol J,2014,65:121-134.
12.American College of Chest Physicians. New Lung Cancer Guidelines Recommends Offering Screening to High Risk Individuals[DB/OL].[2014-10-15].http:/www.chest-net.org/News/Press-Releases/2013/05.
13.Wender R,Fontham ET,Barrera E Jr,et al. American Cancer Society lung cancer screening guidelines[J].CA Cancer J Clin,2013,63:107-117.
14.Callister ME,Baldwin DR,Akram AR,et al. British Thoracic Society guidelines on the investigation and management of pulmonary nodules[J].Thorax,2015,70:794-798.
15.Henschke Cl.International Early Lung Cancer Action Program:Screening protocol.2016-07-01.http:/www.ieclap.org/protocols.
16.Travis WD,Brambilla E,Burke AP,et al. WHO Classification of tumours of the lung,pleura,thymus and heart.4th edition.Lyon:International Agency for Research on Cancer,2015:9-96.
17.Travis WD,Brambilla E,Noguchi M,et al. International Association for the Study of Lung Cancer/American Thoracic Society/European Respiratory Society International Multidisciplinary Classification of Lung Adenocarcinoma[J].J Thorac Oncol,2011,6:244-285.
18.Travis WD,Brambilla E,Nicholson AG,et al. The 2015 World Health Organization Classification of Lung Tumors:Impact of Genetic,Clinical and Radiologic Advances Since the 2004 Classification[J].Journal of Thoracic Oncology,2015,10:1243-1260.
19.许春伟,张博.WHO(2015)肺肿瘤组织学分类[J].诊断病理学杂志,2015,22:815-816.
20.杨欣,林冬梅.2015版WHO肺癌组织学分类变化及其临床意义[J].中国肺癌杂志,2016,19:332-336.
21.张兵林,笪冀平.WHO(2015)肺肿瘤组织学分类解读[J].诊断病理学杂志,2016,23:401-405.
22.张杰,邵晋晨,朱蕾.2015版 WHO肺肿瘤分类解读[J].中华病理学杂志,2015,44:619-624.
23.刘士远,孙铁英.肺癌影像诊断与临床新进展[M].北京:人民卫生出版社,2015.
24.刘士远,陈启航,吴宁.实用胸部影像诊断学[M].北京:人民军医出版社,2012.
25.Goldstraw P,Chansky K,Crowley J,et al. The IASLC Lung Cancer Staging Project:Proposals for Revision of the TNM Stage Groupings in the Forthcoming(Eighth)Edition of the TNM Classification for Lung Cancer[J].J Thorac Oncol,2016,11:39-51.
26.刘士远,范丽,萧毅.加强肺内纯磨玻璃密度结节的影像学研究,提升临床处理水平[J].中华放射学杂志,2017,51:481-483.
27.刘凯,张荣国,涂文婷,等.深度学习技术对胸部X线平片亚实性结节的检测效能初探[J].中华放射学杂志,2017,51:918-921.
28.王云龙,范丽,望云,等.肋骨抑制成像技术在胸片检测不同密度、大小及位置肺结节中的应用[J].临床放射学杂志,2018,37:509-513.
29.邹勤,刘士远,管宇,等.超高分辨率CT对3cm以下肺磨玻璃密度结节的诊断价值[J].临床放射学杂志,2017,36:484-488.
30.望云,范丽,刘士远,等.改变体位联合 CT靶扫描对特殊部位肺结节的诊断价值[J].实用放射学杂志,2016,32:694-698.
31.Rampinelli C,Origgi D,Vecchi V,et al. Ultra-low-dose CT with model-based iterative reconstruction(MBIR):detection of ground-glass nodules in an anthropomorphic phantom study[J].La Radiologia Medica,2015,120:611-617.
32.Ciompi F,Chung K,Riel S J V,et al. Towards automatic pulmonary nodule management in lung cancer screening with deep learning[J].Sci Rep,2017,7:46479.
33.Fan L,Liu SY,Li QC,et al. Multidetector CT features of pulmonary focal ground-glass opacity:differences between benign and malignant.Br J Radiol,2012,85:897-904.
34.涂文婷,范丽,刘士远.肺癌放射组学研究进展[J].中华肿瘤防治杂志,2018,25:604-608.
35.望云,刘士远,范丽,等.含薄壁囊腔周围型肺癌的CT特征及病理基础分析[J].中华放射学杂志,2017,51:96-101.
36.望云,范丽,李清楚,等.薄壁囊腔型肺癌与薄壁空洞性肺结核的MDCT表现鉴别诊断研究[J].临床放射学杂志,2017,36:44-49.
37.李栋.早期中央型肺癌的影像诊断研究进展[J].实用肿瘤杂志,2014,29:196-198.
38.Ramiporta R,Bolejack V,Crowley J,et al. The IASLC Lung Cancer Staging Project:Proposals for the Revisions of the T Descriptors in the Forthcoming Eighth Edition of the TNM Classification for Lung Cancer[J].Journal of Thoracic Oncology,2015,10:990-1003.
39.Asamura H,Chansky K,Crowley J,et al.The International Association for the Study of Lung Cancer Lung Cancer Staging Project:Proposals for the Revision of the N Descriptors in the Forthcoming 8th Edition of the TNM Classification for Lung Cancer[J].Journal of Thoracic Oncology,2015,10:1675-1684.
40.Eberhardt WE,Mitchell A,Crowley J,et al. The IASLC Lung Cancer Staging Project:Proposals for the Revisions of the M Descriptors in the Forthcoming Eighth Edition of the TNM Classification for Lung Cancer[J].Journal of Thoracic Oncology,2015,10:1515-1522.
41.王鑫,支修益.国际肺癌研究协会(IASLC)第八版肺癌TNM 分期解读[J].中华胸部外科电子杂志,2016,3:70-76.
42.Thomas A,Liu SV,Subramaniam DS,et al. Refining the treatment of NSCLC according to histological and molecular subtypes[J].Nat Rev Clin Oncol,2015,12:511-526.
43.Takahashi Y,Shien K,Tomida S,et al. Comparative mutational evaluation of multiple lung cancers by multiplex oncogene mutation analysis[J].Cancer Sci,2018,109:3634-3642.
44.Wang SXY,Lei L,Guo HH,et al. Synchronous primary lung adenocarcinomas harboring distinct MET Exon 14 splice site mutations[J].Lung Cancer,2018,122:187-191.
来源:《中华影像医学·呼吸系统卷(第3版)》
基本概况:个人履历:刘士远,男,主任医师,教授,博士研究生导师。1964年9月出生,山东省临沭县人。1987年7月毕业于第二军医大学医学影像系,获学士学位;1994年7年毕业于第二军医大学,获硕士研究生;1998年6月毕业于复旦大学医学院(原上海医科大学)获博士研究生;2000年6月在上海长征医院博士后出站。任职情况:现任长征医院放射诊断科主任。担任亚洲胸部放射学会主席,中华医学会放射学分会候任主任委员,全军放射学会常务委员,中国医师协会放射医师分会副会长,中国医疗装备协会CT应用专委会主任委员,中国医学影像AI产学研用创新联盟理事长,国家卫生健康委能力建设和继续教育中心“放射影像数据库”专委会主任委员,第二届中国DICOM标准委员会副主任委员等学术兼职;担任《肿瘤影像学杂志》总编,《中华放射学杂志》、《临床放射学杂志》等七本核心期刊副总编。同时担任国家自然科学基金委自然基金初审、会审专家及会审专家组副组长、组长,国家卫健委新冠肺炎专家组影像专家组组长,担任国家及上海市继续教育项目评审专家,解放军总后勤部及上海市设备招标评审专家,中华医学会及上海市医学会医疗事故鉴定专家、人身伤害司法鉴定专家等工作。医疗专长:从事影像诊断工作33年,长期从事肺部疾病影像检查和诊断工作,积累了丰富的影像诊断经验,擅长肺结节的诊断和鉴别诊断。开展了上海地区低剂量CT早期肺癌筛查和肺癌早期诊断和早期治疗研究,创立及优化了肺结节系列技术方案,诊断效能提升34%。完成了上海地区14506例筛查,肺结节检出率29.89%,肺癌检出率1.23%,牵头制定了《低剂量螺旋CT早期肺癌筛查中国专家共识》和《CT辐射剂量诊断参考水平中国专家共识》。首次提出磨玻璃密度结节三分类法,发明了了一种自动获取种子点的磨玻璃结节自动图像分割方法,识别精确度达到96%。应用多种影像定量方法预测纯磨玻璃结节侵袭性;敏感性为93.%,特异性达92%,大大提升了磨玻璃结节临床处理的精准度。聚焦临床需求,构建了多种基于结节影像特征的精准预测模型,包括良恶性判断(敏感度93.4%,准确度86.6%)、I期NSCLC淋巴结转移预测模型(预测效能AUC=0.825)和基于影像组学的EGFR突变预测模型(预测效能AUC=0.798),均取得了良好效果。国内最早开展肺结节深度学习人工智能模型的临床研究,制定了国内外首个肺结节数据标注标准,建立了首个肺结节AI产品国家标准检测库,创建了基于人工智能的肺癌筛查新模式,肺结节AI模型节省阅片时间67%,结节检出效能提升20%。牵头成立了“中国医学影像AI产学研用创新联盟”,编写了首个“中国医学影像AI发展白皮书”。以上结果被引入英国胸科协会指南和加拿大肺结节报告分析系统,并牵头形成了“肺亚实性结节影像学处理中国专家共识”。我院早期肺癌影像诊断正确性94.74%,纯磨玻璃密度结节的肺癌侵袭性判断准确性93%;我院手术切除肺癌早期占比从2012年的35.2%(334例)提升到2018年的63.8%(932例)。研究成果获得上海市科技进步一等奖。获得荣誉:荣获总后勤部育才奖银奖(2009年)、全军首席影像专家(2015年)以及第二届”国之名医.优秀风范”(2018年),入选上海市领军人才计划(2017年)、上海市优秀学科带头人计划(2006年)、上海市21世纪优秀人才计划(2007年)。上海市拥军爱民先进个人(2020年)。科研:作为课题第一负责人获得国家自然科学基金重点项目2项,面上项目4项,国家科技部重点研发重大国际合作项目1项,国家卫健委重点项目1项,上海市科委、卫计委重大科技专项5项,上海及军队重点及面上项目等共计38项4100余万元资助。参编著作:发表学术论文350余篇,SCI论文70余篇,其中单篇最高影响因子53.276。主译专著4部,主编专著、教材9部,副主编6部,主审专著4部,参编专著11部。获得上海市科技进步一等奖等省部级二等以上医疗成果及科技进步奖6项,国家发明专利授权3项。
免责声明
版权所有©人民卫生出版社有限公司。 本内容由人民卫生出版社审定并提供,其观点并不反映优医迈或默沙东观点,此服务由优医迈与环球医学资讯授权共同提供。
如需转载,请前往用户反馈页面提交说明:https://www.uemeds.cn/personal/feedback
来源:人民卫生出版社《临床知识》约稿
作者:刘士远教授,海军军医大学附属长征医院放射诊断科
编辑:环球医学资讯常路







 Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.