29岁女性,现患系统性红斑狼疮且治疗中。本次住院亚急性起病,以胸闷、气急为主要表现,伴有发热;肺CT示双肺多发结节及斑片影、胸膜增厚;外院按社区获得性肺炎给予抗炎及抗感染治疗症状无好转,肺部病灶无明显吸收。该患者所患何病?
【病例简介】
患者女性,29岁,公司员工。因“反复胸闷、气急2个月余”入院。患者于2018年1月无明显诱因下出现低热、关节疼痛、双面颊红斑等症状,外院查血dsDNA抗体阳性,完善相关检查后诊断为“系统性红斑狼疮(systemic lupus erythematosus,SLE)”,予口服“泼尼松、羟氯喹、白芍总苷”治疗后症状无缓解,逐渐出现双侧大腿及双上肢肌肉疼痛。2018年2月起患者出现发热,体温最高达38.9℃,伴有咳嗽、胸闷、气急,故转至当地三甲医院就诊。外院查肺CT示“双肺多发结节及斑片影、胸膜增厚”,考虑“肺部感染”,遂予“甲泼尼龙40mg/d”治疗SLE,先后予“阿奇霉素、左氧氟沙星、头孢哌酮舒巴坦、头孢西丁、莫西沙星、氟康唑”等抗感染治疗,患者症状无缓解。2018年3月26日复查肺CT提示双肺仍有多发炎症。故于2018年3月28日转至我院急诊就诊,查血常规:白细胞计数:4.63×109/L、中性粒细胞:80.6%,血气分析示pH:7.478、二氧化碳分压:4.03kPa、氧分压:10.17kPa,予吸氧及对症治疗,并于2018年3月29日收入我呼吸科。
入院查体
T 38.1℃,P 102次/min,R 22 次/min,BP 118/83mmHg,MEWS评分3分,身高172cm,体重75kg。神志清楚,发育正常。全身浅表淋巴结无肿大。双面颊轻度红斑,全身未见皮下出血点及皮疹。结膜无充血,巩膜无黄染。口唇无发绀。双腮腺区无肿大。颈软,无抵抗,颈静脉无怒张,气管居中,甲状腺无肿大。胸廓对称无畸形,胸骨无压痛;双肺呼吸音粗糙,未闻及干、湿性啰音。心率102次/min,律齐,各瓣膜听诊区未闻及杂音。腹平坦,腹壁软,全腹无压痛,无肌紧张及反跳痛,肝脾肋下未触及,关节无红肿,无杵状指(趾),双下肢无水肿。生理反射存在,病理反射未引出。
既往史及个人史
否认高血压病、糖尿病、肝炎等病史。否认吸毒史、吸烟史、酗酒史,否认冶游史。无家族性肿瘤及结缔组织疾病史。
辅助检查
血常规:白细胞计数:10.63×109/L,中性粒细胞计数:70.3%,淋巴细胞计数:24.1%,单核细胞计数:4.1%,血红蛋白:86g/L,血小板计数:354×109/L。
尿常规:尿蛋白+,红细胞管型。
血沉:60mm/h。
PCT:0.13ng/ml。
心脏超声:三尖瓣少量反流,估测肺动脉收缩压25mmHg,心内结构未见明显异常。
初步诊断
1.肺部阴影待查
2.系统性红斑狼疮(SLE)
【病例解析】
问题1:患者SLE诊断是否明确?
SLE是一种病因未明的慢性自身免疫性疾病,可累及几乎任何身体器官。患者可出现不同的临床表现,从轻微的关节和皮肤受累到危及生命的肾脏、血液系统或中枢神经系统受累。根据2012年系统性红斑狼疮国际临床协作组(Systemic Lupus Erythematosus International Collaborating Clinics,SLICC)诊断标准,SLE的患者需要满足17项标准中的至少4项,其中包括11项临床标准中的至少1项和6项免疫标准中的1项,或患者存在ANA抗体或抗dsDNA抗体的情况下,具有与SLE相符的经活检证实的肾炎。本患者为育龄期女性,临床特点有皮疹、关节疼痛、肾脏损害、相关免疫学指标阳性,且经治疗后皮疹及关节疼痛较前好转,故诊断明确。
问题2:抗感染失败的原因是什么?
患者病史有如下特点:①青年女性,现患SLE且治疗中。本次住院亚急性起病,以胸闷、气急为主要表现,伴有发热;②肺CT示双肺多发结节及斑片影、胸膜增厚;③外院按社区获得性肺炎给予抗炎及抗感染治疗症状无好转,肺部病灶无明显吸收。对于抗感染治疗失败的患者,可能有以下几种原因:①特殊微生物感染,经验性治疗未覆盖致病原;②虽然致病原已覆盖,但是药物通透性/剂量/浓度未能达到治疗要求;③误吸/排痰障碍/合并症等宿主因素影响治疗效果;④耐药菌感染所致抗感染无效;⑤非感染性疾病,如肺栓塞、肺血管炎、机化性肺炎、结节病、淋巴瘤、肺癌和结缔组织病累及肺部等。本例患者新近确诊为SLE,口服激素抗炎治疗,免疫力下降,故存在机会感染的可能性。由于此前外院给予多种抗生素治疗均以失败告终,故该患者抗感染失败的原因可能为:特殊病原菌感染和/或各种非感染性疾病的肺累及等。为进一步明确诊断,入院后完善了以下检查:
辅助检查
动脉血气分析:pH:7.48,PaO2:76.3mmHg,PaCO2:30.2mmHg,SaO2:95.8%。
血常规:白细胞计数:3.72×109/L,血红蛋白:86g/L,中性粒细胞计数:89.5%,淋巴细胞:5.1%,血小板计数:257×109/L。
G试验、T-SPOT、呼吸道九联抗体、乳胶凝集试验、ASO、肿瘤标志物检测:均正常。
PCT:0.16ng/ml,CRP:20.2mg/L,ESR:26mm/h。
嗜伊红细胞计数:22×106/L,IgE:962.4ng/ml。
ANA:1∶100,dsDNA、抗SM抗体:阴性。
肺泡灌洗液直接涂片及培养:见烟曲霉。
细菌、结核涂片及培养:阴性。
肺泡灌洗液细胞分类:有核细胞计数:2600×106/L,中性粒细胞50%,淋巴细胞30%,间皮细胞20%。
胸部CT(2018-04-02):右侧气胸,肺被压缩约60%;两肺多发斑片影,部分实变;双侧少量胸腔积液。病灶较外院胸部CT检查快速进展(图1)。
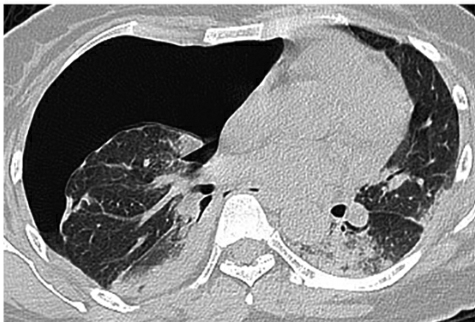
图1胸部CT:右侧气胸,肺组织压缩约60%;两肺多发斑片影,部分实变,以胸膜下为主;双侧少量胸腔积液;纵隔左移
心脏超声:极少量心包积液,左心收缩功能正常。静息状态下右心结构未见异常,右心功能未见异常。
电子支气管镜检查:气管、左右主支气管及各叶、段支气管管腔通畅,黏膜光滑,未见新生物,右下叶基底段可见少量脓性分泌物,予以吸除并灌洗,送检病原学检查。于右下叶后基底段行经支气管镜肺活检(TBLB)送病理检查。
BALF细胞分类:以中性粒细胞为主。
BALF病原学检查:涂片发现烟曲霉,并培养出烟曲霉。
我院复查肺CT提示双下肺病灶较前进展,且部分实变,伴有右侧气胸。根据病史及病原学结果,考虑患者存在肺曲霉菌感染。既往外院抗感染治疗中曾用氟康唑,不能覆盖烟曲霉,可能为患者症状及肺部病灶进展的原因。
问题3:患者为何种类型肺曲霉菌病?
肺曲霉菌病主要由烟曲霉引起,临床上表现为三种类型,即侵袭性、寄生性、过敏性。侵袭性肺曲霉菌病又可分为急性、亚急性、慢性。急性侵袭性肺曲霉菌病(invasive pulmonary aspergillosis,IPA)早期出现胸膜下密度增高的结节实变影和/或楔形实变影、团块状阴影,病灶周围可有晕轮征;数天后肺实变区液化、坏死,出现空腔阴影或新月征。亚急性侵袭性肺曲霉菌病( subacute invasive aspergillosis,SAIA)感染的时间小于3个月,通常在轻度或中度免疫抑制患者中发生,典型的好发人群有糖尿病、高龄、慢性阻塞性肺疾病、结缔组织疾病。慢性侵袭性肺曲霉菌病(chronic invasive aspergillosis,CPA)进展较缓慢,通常发生在有慢性肺部疾病的患者中,但不伴随或只有轻度的免疫缺陷。寄生型肺曲霉菌病包括肺曲霉球、寄生性支气管曲霉病。曲霉球发生在非免疫抑制患者中的包含真菌球的单发肺部空腔,患者伴有轻微或无任何症状,在就诊前至少3个月没有任何影像学进展。过敏性肺曲霉菌病主要有变应性支气管肺曲霉菌病(allergic bronchopulmonary aspergillosis,ABPA),该类患者可表现为哮喘发作,其影像学特点有中心性支气管扩张、指套征、牙膏征、游走性肺部浸润,此外血清烟曲霉特异性IgE升高,血清总IgE水平大于1000U/ml。本例患者的临床特点更符合SAIA,因此给予抗曲霉菌治疗。
【治疗】
1.抗真菌治疗
一项回顾性研究发现,使用伏立康唑治疗侵袭性肺曲霉菌病能显著降低死亡率,因此几乎所有指南都推荐伏立康唑作为首选用药。伏立康唑200mg/12h,静脉滴注。
2.治疗基础疾病
甲泼尼龙40mg/d,静脉滴注,羟氯喹250mg/次,2次/d,口服。
3.气胸的治疗及其他对症支持治疗
吸氧,胸腔闭式引流。
疗效评估:
1.体温逐渐下降,治疗72小时后体温正常,胸闷、气急较前明显好转,肺部听诊无哮鸣音及湿啰音。
2.1周后复查化验结果:血常规:白细胞计数:7.21×109/L,血红蛋白:90g/L,中性粒细胞:87.3%,淋巴细胞:4.7%,血小板计数:295×109/L。PCT 0.07ng/ml,CRP<3.13mg/L,ESR 14mm/h。
3.1周后复查肺CT(2018-04-08):气胸基本吸收,双下肺实变影及斑片影明显吸收,双肺胸膜下可见磨玻璃影和间质性改变,胸膜局限性增厚(图2)。肺部病灶较前明显改善,提示治疗有效。
问题4:肺部间质性改变是否也为曲霉菌感染所致?

图2伏立康唑治疗1周后复查胸部CT:右侧气胸基本吸收,双下肺实变影及斑片影明显吸收,双肺胸膜下可见磨玻璃影和间质性改变,局限性胸膜增厚
患者经伏立康唑治疗后双下肺实变影及渗出影明显吸收,但双肺下叶胸膜下可见磨玻璃影及间质增生,双侧胸膜不规则增厚。肺组织TBLB病理(2018-04-08,图3)显示(右下叶后基底段活检)肺泡壁慢性炎症细胞浸润,肺泡腔内见纤维素性渗出,肺泡上皮增生,结合临床,符合结缔组织病肺损伤。免疫组化结果:CK(+),VIM(+),CgA(-),Syn(-),TTF-1(0),WT-1(-),LCA(+),P63(-/+),NapsinA(+),P40(-/+)特殊染色结果:特染PAS(-),抗酸(-),银染(-)。至此,结合患者病史特点、影像学表现、病理结果和对伏立康唑、糖皮质激素以及免疫调节剂治疗反应良好,可做出最后诊断。
:见肺泡壁慢性炎症细胞浸润,肺泡腔内见纤维素性渗出,肺泡上皮增生.jpg)
图3右肺下叶后基底段TBLB病理(HE,×400):见肺泡壁慢性炎症细胞浸润,肺泡腔内见纤维素性渗出,肺泡上皮增生
【最终诊断】
1.亚急性侵袭性肺曲霉菌病
2.系统性红斑狼疮相关性间质性肺病
3.系统性红斑狼疮
【随访】
患者诊断明确且初步治疗有效后,继续院外口服伏立康唑、甲泼尼龙、羟氯喹治疗。定期随访,胸闷、气急症状基本好转,体温恢复正常。
【病例点评】
1.系统性红斑狼疮相关性间质性肺病(systemic lupus erythematosus-associated interstitial lung disease,SLE-ILD)
SLE是常见的系统性自身免疫性疾病,多系统受累和血清中出现核抗原诱导的自身抗体反应是本病的主要临床特征。SLE好发于育龄期女性,多见于15~45岁年龄段,我国的患病率约为70/10万人。50%以上的SLE患者会出现肺部病变,主要表现为胸膜炎、间质性肺疾病、肺泡出血、肺萎缩综合征、肺动脉高压、气道疾病和肺血栓栓塞性疾病,其中SLE-ILD的发生率约1%~15%。SLE-ILD的典型表现为劳力性呼吸困难,并可能出现干咳,肺功能检查可发现限制性肺通气功能障碍,弥散下降。SLE-ILD最常见的病理类型是非特异性间质性肺炎(nonspecific interstitial pneumonia,NSIP),而机化性肺炎(organizing pneumonia,OP)、淋巴细胞间质性肺炎(lymphoid interstitial pneumonia,LIP)、普通型间质性肺炎(usual interstitial pneumonia,UIP)、脱屑性间质性肺炎(desquamative interstitial pneumonia,DIP)和弥漫性肺泡损伤(diffuse alveolar damage,DAD)相对少见。临床上,定期对SLE患者行HRCT及肺功能检查有助于早期发现ILD等肺部病变。
2.SLE合并继发感染
SLE患者免疫抑制治疗过程中易出现机会感染,因此当患者出现呼吸困难、发热等症状时,必须排除感染,尤其是条件致病菌的感染。当患者出现肺部不明原因阴影时,应考虑借助支气管镜行病原学及病理学检查以明确诊断。对于出现急性发热、胸痛、气促症状的SLE患者还应排除狼疮性肺炎(lupus pneumonia,LP)。LP是SLE患者的一个致死性综合征,具有急性间质性肺炎(acute interstitial pneumonia,AIP)样反应特征,死亡率高达50%。LP患者咯血少见,肺部听诊可闻及细湿啰音,HRCT表现为双侧肺泡炎症(毛玻璃样)或纤维化(蜂窝样),可伴有肺不张、胸腔积液。此外,对于出现不能用上述原因解释的呼吸困难者,还应警惕肺血栓栓塞性疾病。尤其是抗心磷脂抗体阳性的SLE患者,发生深静脉血栓(deep vein thrombosis,DVT)或肺栓塞(pulmonary embolism,PE)的风险明显增加。
免责声明
内容来源于人卫知识数字服务体系、人卫inside知识库,其观点不反映优医迈或默沙东观点。 此服务由优医迈与胤迈医药科技(上海)有限公司授权共同提供。
如需转载,请前往用户反馈页面提交说明:https://www.uemeds.cn/personal/feedback
人卫知识数字服务体系





 Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
