27岁男性,无明显诱因出现发热,最高体温为39.5℃,伴有咳嗽、咳痰(痰为白色泡沫状,约50ml/d),左侧胸痛,无咯血,无畏寒。本例患者所患是不是感染性肺部疾病?
一、入院疑诊
(一)病例信息
【病史】
男性患者,27岁,2014年4月28日无明显诱因出现发热,最高体温为39.5℃,伴有咳嗽、咳痰(痰为白色泡沫状,约50ml/d),左侧胸痛,无咯血,无畏寒,5月14日至当地医院就诊,考虑为“左上肺占位:肺癌?肺结核?肺部感染?”,并于5月23日全身麻醉下行左上肺切除术,术后病理检查显示左上肺炎性病变。患者于6月7日症状缓解出院,出院后继续抗结核治疗,有乏力、胸痛、声嘶症状,偶有咳嗽、咳痰。7月10日,患者再次出现发热,胸痛明显,稍活动即感气促,休息后可缓解,于当地医院住院继续抗结核治疗,症状无缓解。患者于7月31日至8月8日到某市医院就诊,经支气管肺活检及T-SPOT等检查,排除肺结核,遂停用抗结核药物。8月9日,患者转至上级医院就医,仍有发热(最高体温为39.4℃),无脱发、皮疹及关节痛,有咳嗽、咳痰(白色黏痰,量少)、胸痛、气促。患者发病以来,精神差,睡眠差,食欲差,大小便无异常,体重减轻15kg。
患者既往有乙肝病史10余年,否认鸽类、牛羊等动物接触史,无饮酒史。
【体格检查】
体温37.8℃,脉搏84次/分,呼吸22次/分,血压110/76mmHg。慢性病容,左侧胸部可见一长约15cm手术切口,伤口愈合良好。左上肺语颤减弱,叩诊浊音,呼吸音低,可闻及少量湿啰音;右肺呼吸音粗,无啰音;无胸膜摩擦音。心律齐,心率84次/分,未闻明显病理性杂音。腹部未见明显异常。双侧下肢无水肿。
【实验室检查】
外周血白细胞计数(WBC) 9.7×109/L,中性粒细胞计数(N)7.5×109/L,中性粒细胞百分比(N%)78%,Hb 96g/L,PLT 586×109/L。尿常规无异常。
【影像学检查】
2014年8月6日胸部CT:左肺上叶支气管呈术后改变,支气管残端显示不清。左上叶前段可见大片状密度增高影,边缘模糊,平扫CT值46HU,增强后CT值73HU。双肺野内和胸膜下可见散在大小不等结节状密度增高影,边缘模糊,较大者位于右下叶背段,大小约2.4cm×1.8cm,气管、支气管通畅,纵隔内可见多个小淋巴结,较大者直径8mm。无胸腔积液征象(图1、图2)
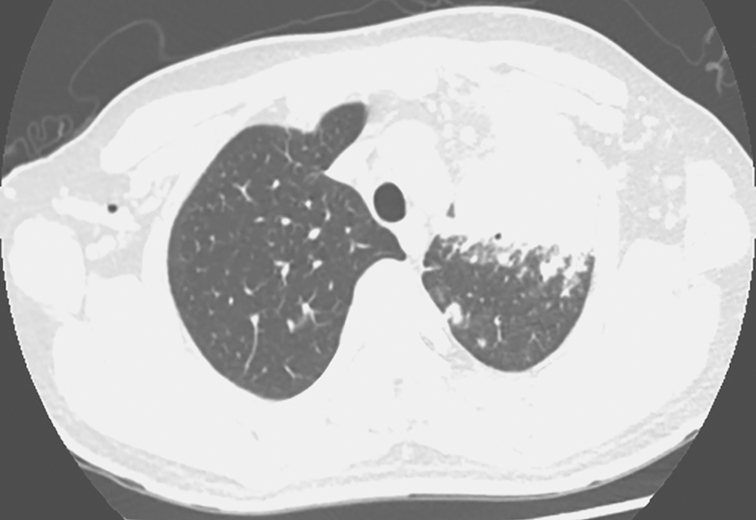
图1 发病第3个月胸部CT表现
胸部CT可见左上肺大片高密度影伴空洞
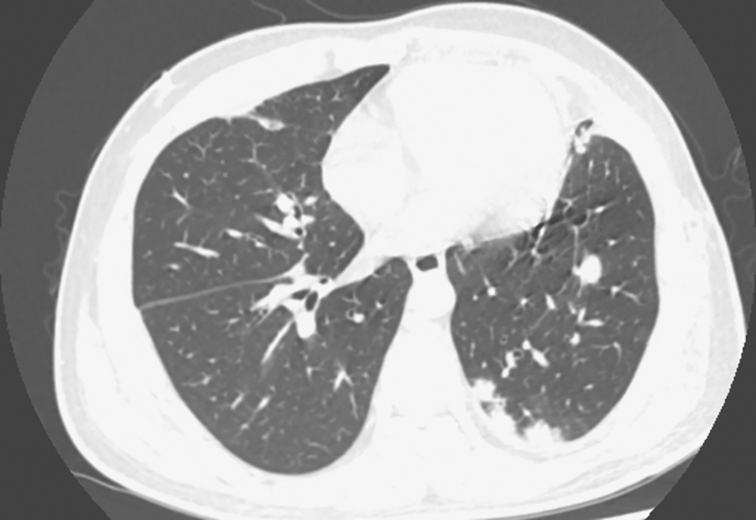
图2 发病第3个月胸部CT表现
胸部CT可见双肺多发结节灶
(二)临床思辨
【临床特点】
1.患者为青年男性,起病急。
2.主要症状和体征为高热、咳嗽、咳白痰、胸痛,左上肺可闻湿啰音。
3.实验室检查示外周血中性粒细胞略高。
4.影像学检查可见切除左上肺占位性病变后2个月,双肺新发结节病灶,左下肺出现空洞、斑片影,部分病灶密度稍变淡。
5.手术切除及抗结核等治疗后,患者仍表现出类似术前症状(高热、咳嗽、咳白痰、胸痛)的特点,并有气促,提示治疗无效。
【思辨要点】
肺部疾病的常见症状和体征包括发热、咳嗽、咳痰、胸痛、呼吸困难、肺部湿啰音,但这些表现并无病因特异性,许多原因均可表现为同样的症状和体征。对具有发热及呼吸系统症状、疑似感染性肺疾病者,在确立诊断的过程中需要明晰以下问题:
1.本例患者所患是不是感染性肺部疾病?
判断长程发热的病因究竟是不是感染所致,需要排除结缔组织疾病、肺栓塞和肿瘤等非感染性因素。结缔组织疾病的临床表现除了发热外,常伴有肾、关节、皮肤、肌肉和血液等多系统损害,单一累及肺组织者少见。当累及肺组织时,大多是双肺弥漫性间质病变或弥漫性肺泡出血,很少是单一肺叶受累,与本病例不符。此外,在短期内肺部高密度浸润影病灶合并结节、空洞病变的结缔组织疾病多见于韦格纳肉芽肿等原发性或继发性血管炎,但该病多合并慢性鼻炎、鼻窦炎、眼炎等和(或)肾损伤,肺内病灶具有多形性、多变性,在病理标本中可以找到血管壁或周围炎症改变,其病变具有一定特异性。受损血管病理呈肉芽肿样、坏死性或栓塞性等改变,免疫荧光镜检可见血管壁免疫复合物沉积等表现。本病例病理标本无上述血管炎特征改变及血管栓塞,故可以排除肺栓塞,结缔组织疾病可能性亦不大,但仍需进一步检查抗中性粒细胞抗体、抗内皮细胞抗体(anti-endothelial cell antibody,AECA)等以排除之。
在非感染性肺疾病中,发热伴肺部病变还有可能发生于肿瘤性肺疾病,如肺炎型淋巴瘤、肺泡癌及类肿瘤等。肺炎型淋巴瘤往往表现为肺实变,可短期内进展,影像学检查可见类结节改变,病理改变为淋巴瘤细胞浸润。本病例术后病理为左上肺炎性病变,明显不符合肺炎型淋巴瘤的病理表现,也不支持肺泡癌诊断。对于患者术后结节改变,可行支气管镜检查及肺穿刺活检以进一步排除类肿瘤性疾病。
综上分析,根据总体临床进程,本病例为感染可能性最大,需要进一步排除结缔组织疾病及类肿瘤性疾病。
2.本病例可能是哪种感染类型?最可能是哪种病原体?
本例患者为青年男性,平时身体健康,如果是肺部感染,应当首先考虑CAP。患者前期治疗情况及相关资料缺如,鉴于患者无结构性肺病等病史,原发于非发酵菌(如铜绿假单胞菌、鲍曼不动杆菌和嗜麦芽窄食单胞菌等)感染的可能性小。金黄色葡萄球菌,包括甲氧西林敏感性(MSSA)和耐甲氧西林金黄色葡萄球菌(MRSA),均可引起社区获得性感染。MRSA所致感染发展迅速,中毒症状重,患者往往咳脓痰,与本例患者临床情况不符。厌氧菌感染往往有误吸因素,痰液为脓臭痰,亦与本例患者临床情况不符,不予考虑。病毒也是成人社区获得性肺炎的一种常见病原。其中,巨细胞病毒多见于免疫功能低下患者,且进展迅速;流感病毒、鼻病毒、腺病毒和偏肺病毒等引起的感染,患者外周血WBC计数多正常或降低,亦很少呈迁延状态或亚急性过程,病变多为间质改变。而本例患者表现为结节和实变病变,因此可以基本排除由病毒引起肺部感染的可能性。根据患者机体基础免疫功能不同,可将肺部侵袭性真菌病分为原发性和继发性两类。原发性真菌病的病原菌主要有隐球菌、马尔尼菲青霉菌、曲霉菌、组织胞浆菌、皮炎芽生菌等,其所致感染大部分具有地方性特征,如我国南方地区多发隐球菌、马尔尼菲青霉菌感染。继发性真菌病患者多有器官移植术、粒细胞缺乏、长期激素使用等,常见致病真菌多为条件致病菌,如假丝酵母菌、曲霉菌、隐球菌、接合菌和肺孢子菌等。引起病变呈结节改变的常见致病真菌主要为曲霉菌和隐球菌。典型的曲霉感染影像学表现为晕征和新月征,也可见空洞。隐球菌感染者影像学表现可见结节和实变影。对于本例患者,需要做进一步检查,以排除曲霉菌和隐球菌感染等。
综上所述,本病例是由非发酵菌、金黄色葡萄球菌、病毒引起感染的概率很小,应着重考虑非典型病原体(肺炎支原体、肺炎衣原体和军团杆菌)、革兰阳性菌,亦不能排除真菌和胞内病原体,并且须完善相关检查,进一步排除非感染性因素可能导致的病变。
二、诊治过程
(一)临床信息
【实验室检查】
1.一般检查
(1)血常规(多次检查):WBC(10.20~15.80)×109/L,N% 77%~88.6%,Hb 82~96g/L,PLT(556~642)×109/L。
(2)血沉(多次检查):82~120mm/1h。
(3)肝肾功能(多次检查):丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)正常,血清白蛋白(ALB) 28.7~33.5g/L,血尿素氮(blood urea nitrogen,BUN)1.82~2.25mmol/L,肌酐(Cr)54.7~63μmol/L
2.免疫相关检查
自身抗体(包括抗核抗体、抗dsDNA、Sm抗体、抗线粒体抗体等)阴性,ANCA阴性。
3.感染相关检查
PCT 0.24ng/ml,CRP 202mg/L,D-二聚体(D-dimer)0.9mg/L;结核菌素纯蛋白衍化物(PPD)试验阴性;T淋巴细胞刺激γ-干扰素释放试验(T-SPOT)阴性。
血清病原抗体(包括梅毒螺旋体、结核分支杆菌、肺炎支原体、肺炎衣原体、军团杆菌、Q热立克次体等)均阴性;真菌检测(G试验和GM试验)均阴性;血培养2次,均阴性;痰病原检测(包括普通细菌、真菌、抗酸染色和寄生虫)5次,均阴性;大便抗酸染色和寄生虫检查均阴性。
4.肿瘤标志物检测
铁蛋白>600ng/ml,糖类抗原125(carbohydrate antigen 125,CA125)264.89kU/L。
【支气管镜检查】
支气管镜检查见左上叶上部开口黏膜肿胀、肥厚明显,管腔狭窄。支气管镜勉强进入后,见后支外压闭塞,前支及尖支狭窄,远端见白色物,其余各叶段支气管通畅(图3)。支气管镜分泌物病原检测均阴性(包括普通细菌、真菌、抗酸染色),PAS染色阴性。
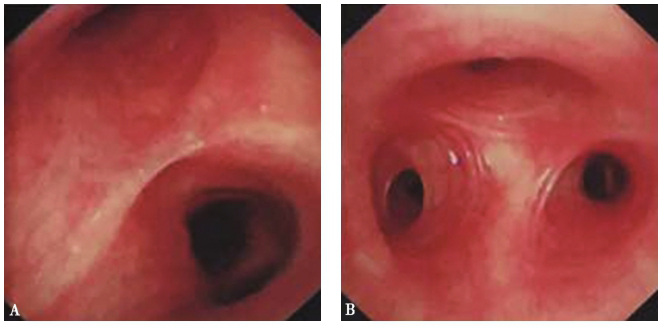
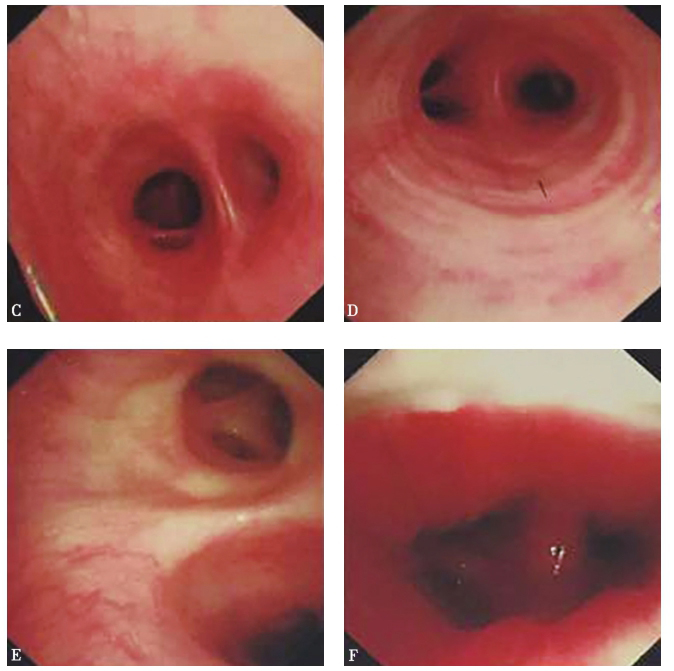
图3 支气管镜检查镜下所见
左上叶段支气管上部开口黏膜肿胀、肥厚明显,管腔狭窄,其中B2段外压性闭塞,B1和B3段狭窄,远端见白色物
【影像学检查】
入院治疗后,复查胸部CT见左肺上叶前内段大片状密度增高影,范围较前缩小,内可见含气支气管征,边界模糊,平扫CT值约37HU。双肺内、胸膜下散在大小不等结节状密度增高影,部分较前缩小,小部分较前增大,总体较前好转,边缘模糊,较大者仍位于右下叶背段,气管支气管通畅,纵隔多个小淋巴结,大致同前。左侧胸腔后部少量弧形液性密度灶(图4)。
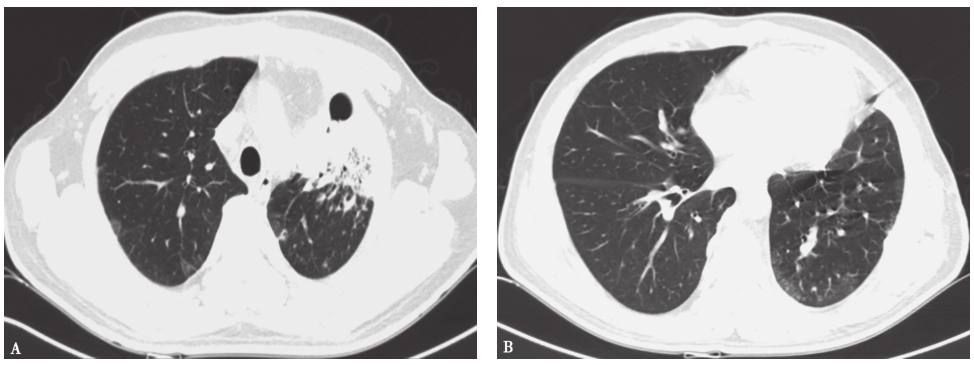
图4 发病第4个月胸部CT表现
胸部CT可见左上肺大片高密度影伴双肺多发结节灶
(二)临床思辨
患者入院后所做系列检查显示:①患者白细胞及中性粒细胞、降钙素原、C反应蛋白、D-二聚体、血沉增高,提示存在感染;②自身抗体及ANCA均阴性,结合临床表现,基本可以排除结缔组织疾病;③支气管镜检查见后支外压闭塞,前支及尖支狭窄,远端见白色物;④胸部CT可见渗出实变范围缩小,部分结节变小,边缘模糊;这些结果均支持本病例为感染性病变。
此时需要思考以下问题:
1.如果本病例为感染性疾病,应如何展开经验治疗?
对于本例患者,致病病原体应重点考虑非典型病原体(肺炎支原体、肺炎衣原体和军团杆菌)、革兰阳性菌,胞内病原体和真菌亦不能排除。遵循社区获得性肺炎(CAP)治疗指南,依次使用氟喹诺酮类、碳氢酶烯类、多西环素、伊曲康唑、氟康唑等抗感染药物,所覆盖的病原包括常见的肺炎链球菌、流感嗜血杆菌、非典型病原(肺炎支原体、肺炎衣原体和军团杆菌)、常见革兰阴性菌(肺炎克雷伯菌等)、曲霉菌、隐球菌等真菌。尽管规范应用多类抗感染药物治疗,但患者体温未下降,病情无好转迹象。入院后的系列检查结果仍符合感染的发病过程,因此,判断其可能是由一些特殊病原引起的感染,有必要积极鉴定感染病原,尽快实现目标性抗感染治疗。
针对少见革兰阳性球菌,患者痰液为白色,与葡萄球菌属感染表现不符;而肠球菌(如粪肠球菌、屎肠球菌等)为条件致病菌,致病力不强,院内感染近年有增高趋势,健康者社区罹病少见,需要进一步排除。对于初始抗生素或反复更改抗生素治疗无效的肺部感染患者,还需注意肺放线菌病和肺诺卡菌病、梭状芽孢杆菌属感染等可能。少见革兰阴性菌包括革兰阴性需氧和兼性厌氧杆菌(如对碳氢酶烯类耐药的普登威斯菌属)、条件致病菌(拉乌尔菌属等)、肠杆菌科、非发酵革兰阴性杆菌(如类鼻疽伯克霍尔德菌及放射根瘤菌、罗尔斯通菌属等)、革兰阴性苛养菌(如布鲁菌属)等。这些少见革兰阴性菌往往对呼吸喹诺酮类及头孢哌酮舒巴坦或四环素、磺胺、利福平等敏感。本例患者前期治疗使用了呼吸喹诺酮及头孢哌酮舒巴坦、多西环素,覆盖上述病原体,故其感染可能性小,但需要进一步排除。
此外,本例患者氟康唑治疗无效,亦不支持隐球菌病诊断。肺毛霉菌、马尔尼菲青霉菌和组织胞浆菌感染影像学也常见结核样结节表现,非结核分枝杆菌感染亦可表现为长程发热、肺部实变及结节改变,均需要进行鉴别。必要时需经病理专家重新阅读组织病理片和特殊染色等进一步确诊。
2.如何鉴定病原?如何选择鉴定病原的最佳方法?
确定感染病原,可通过无创和有创手段获得标本,进行相关检测。
(1)本病例经无创手段获得标本进行了培养病原(外周血、呼吸道分泌物和BALF等)、分子生物学核酸检测、抗体检测(血清抗体酶联免疫吸附法)和机体病原免疫反应检测(PPD、T-SPOT等)等,均无阳性发现。但是需要注意,肺放线菌是一种难培养的厌氧菌,生长缓慢,许多医院未常规做厌氧培养,检出阳性率低;诺卡菌生长亦缓慢,多数需2~7天,有时需4~6周,有此怀疑时,须通知检验人员,并做改良抗酸染色直接镜检。
(2)通过有创手段获取标本包括CT引导下穿刺、B超引导下胸膜下结节穿刺、气道超声内镜引导下穿刺和外科胸腔镜手术等。考虑有放线菌等感染可能时,通过有创手段获取病原体检测的阳性率比支气管镜检查高,且可避免污染的可能。对于本病例,可以利用外院手术标本进行重新核查。
三、临床确诊
(一)临床信息
将患者外院左上肺手术切除标本进行病理会诊。病理可见:①大部分肺组织实变,肺泡壁增厚,慢性炎症细胞浸润,肺泡腔内渗出,纤维增生及机化,表现为炎症改变;②部分区域肌成纤维细胞增生明显,伴慢性炎症细胞浸润,肺泡组织消失,呈实体状,炎性肌成纤维细胞瘤样改变(图5);③肺泡上皮细胞增生明显,呈立方或低柱状,少数有轻度异型性,形成的肺泡样结构形态不规则;④免疫组化ALK弱阳性,Actin强阳性,EBET(原位杂交)阴性,结合特殊染色,考虑为马红球菌感染。
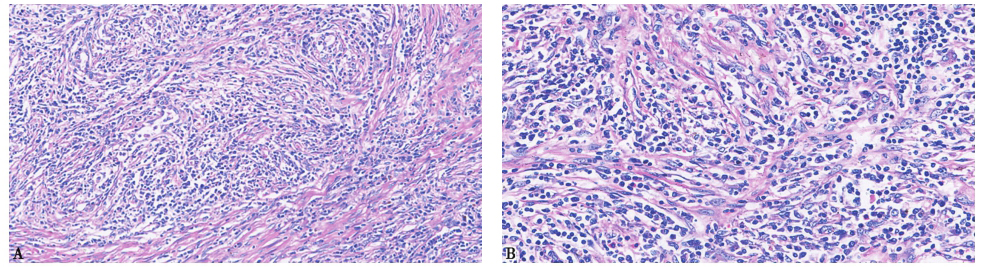
图5 左上肺组织病理表现
A.HE染色,200×;B.HE染色,400×
最后诊断:马红球菌肺炎。
经万古霉素及环丙沙星等治疗后,患者体温恢复正常,呼吸道症状明显改善。
(二)临床思辨
利用手术标本,通过多学科协作,本例患者肺内感染病变的性质终于明确,诊断为马红球菌肺炎,这也解释了为何前期短程普通经验性抗感染治疗无效。
马红球菌为革兰阳性无动力菌,细胞内兼性寄生菌,是人类少见的机会性致病菌,易发生于细胞介导免疫受损的患者,常导致慢性或亚急性感染性多器官病变,可引起艾滋病、血液病、骨髓炎和肾移植术后等患者肺部感染、血液感染、尿路感染及胸腔感染等。其可能的感染途径有自土壤吸入、消化道摄入、直接进入伤口或黏膜等。近年国内已陆续报道马红球菌感染病例,其中呼吸道、尿路感染较多。其临床表现最多见败血症,其次为局部化脓性感染,如肌内注射部位感染、肺炎。人类马红球菌感染的发病机制尚不清楚,一般认为马红球菌具有持续破坏肺泡巨噬细胞能力是其致病基础。马红球菌肺炎的临床和影像学表现无特异性。其确诊依赖细菌培养,尤其是血标本培养。马红菌生长缓慢,菌落呈黏液状,产生橘红、橙红色素,细菌形态呈多形态性,以卵圆形、球杆状为主,不能分解任何糖醇类,触酶阳性。鉴别马红球菌,除依据其产生色素特征外,还可参考以下特征:①不分解任何糖类(可与棒状杆菌属区别);②动力阴性、不分解七叶苷(可与李斯特菌区别);③触酶阳性、硫化氢阴性(可与丹毒丝菌区别);④触酶阳性、七叶苷阴性(可与肠球菌区别);⑤产生黏液型菌落(可与星形诺卡菌区别,诺卡菌菌落干燥)。对于马红球菌感染,宜选用具有良好细胞穿透能力的抗生素长疗程、联合治疗。
1.对于本例患者,为什么不诊断炎性肌成纤维细胞瘤?
2002年WHO将炎性肌成纤维细胞瘤(inflammatory myofibroblastic tumor,IMT)定义为由分化的肌成纤维细胞性梭形细胞组成,常伴大量浆细胞和(或)淋巴细胞的一种间叶性肿瘤。肿瘤细胞遗传学研究发现其有染色体异常,少数细胞呈梭形,具有复发倾向及恶变潜能。因此,IMT与炎性假瘤不是同一疾病,其实为一种真性肿瘤。
炎性肌成纤维细胞瘤的临床表现取决于发病部位,起病多较隐匿,临床症状多由肿块本身及压迫周围脏器引起,并可有发热、体重下降、疼痛、贫血、血小板增多、血沉加快等,与恶性肿瘤相似,但均缺乏特异性,症状和体征往往在肿瘤切除后消失。其影像学表现多样,一般具有以下征象:①周围型病变表现为不规则肿物,多为单发病灶,位于邻近胸膜肺组织内,病变某一层面可见一侧边缘平直、呈刀切样改变(即平直征,可能是病灶边缘纤维化牵拉所致,也可能与病灶沿肺叶或段的边形成有关),病变边缘也可呈尖角状改变(可能是病灶周围胸膜粘连及纤维组织增生所致);②中心型病变边界较清楚,可伴肺不张,内部可见形态多样的钙化,尤以儿童患者常见;③CT可见软组织密度肿块,增强扫描呈均匀或不均匀强化。之所以出现如此复杂的增强现象,主要是由于组织结构内血管成分以及组织成分不同,可出现高度均匀强化、肿块周围强化或肿块无强化。其中,较具特征性的表现是肿块高度均匀强化及周围增强程度高于中心部。
本例患者肺内肿块切除后,症状未消失,并出现新的肺内实变,结节强化特征亦不符合炎性肌成纤维细胞瘤。
2.为什么本例患者胸部CT显示病变有部分吸收,部分结节增大?
药敏试验显示,马红球菌通常对喹诺酮类、四环素类敏感,对青霉素、利福平、大环内酯类、多黏菌素耐药。本例患者住院过程中曾短程使用多西环素及喹诺酮类,可能对部分浸润性病灶有效,但马红球菌病常为亚急性或慢性病程,对于结节机化较明显的病灶,需较长疗程(8~12周),并在随访过程中根据病灶吸收情况适当调整抗感染策略和疗程。本例患者肺内病灶吸收较为缓慢,有的甚至增大,主要是由于抗感染疗程相对不足所致,部分病灶增大可能与感染相关免疫反应有关,在实际临床工作中应引起高度重视。
精要回顾与启示
肺部炎性占位病变手术切除后,肺内新发实变及结节伴高热是呼吸系统疾病临床诊治难点之一,此时,临床医师常会考虑真菌及少见细菌感染等。对于少见革兰阳性球菌,要注意肠球菌(如粪肠球菌、屎肠球菌等)为条件致病菌,致病力不强。对于初始抗生素或反复更改抗生素治疗无效的肺部感染患者,还须注意马红球菌肺炎、肺放线菌病和肺诺卡菌病、梭状芽孢杆菌属感染等可能。对于少见革兰阴性菌,要注意可能对碳氢酶烯类耐药的普鲁威登菌属及常继发于糖尿病的类鼻疽伯克霍尔德菌、布鲁菌属等。如果按常见细菌或真菌治疗未获得理想的结果,应该考虑多种少见病原体感染,及时通知检验人员结合临床特点做特殊染色、厌氧培养、延长培养观察时间。
本病例说明:①肺部感染的表现呈多样性、复杂性,大大增加了临床确诊难度;②充分利用手术标本,快速进行病理检验,若为感染病灶,很有必要及时进行细菌培养及特殊染色。
免责声明
内容来源于人卫知识数字服务体系、人卫inside知识库,其观点不反映优医迈或默沙东观点。 此服务由优医迈与胤迈医药科技(上海)有限公司授权共同提供。
如需转载,请前往用户反馈页面提交说明:https://www.uemeds.cn/personal/feedback
1.PANAGIOTOPOULOS N, PATRINI D, GVINIANIDZE L J, et al. Inflammatory myofibroblastic tumour of the lung: a reactive lesion or a true neoplasm?[J]. J Thorac Dis, 2015, 7(5): 908-911.
2.CISEK A A, RZEWUSKA M, WITKOWSKI L, et al. Antimicrobial resistance in Rhodococcus equi[J]. Acta Biochim Pol, 2014, 61(4): 633-638.





 Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
