胃肠间质瘤(gastrointestinal stromal tumors,GIST)超过10cm并不多见,且在胃肠道外发生率较高。文献报道巨大GIST约占GIST的17.2%,与普通高危组GIST相比,巨大GIST在生物学特性、治疗方式及预后等方面有其独特之处。本例介绍1例十二指肠巨大GIST患者,以供大家参考。
【病例摘要】
患者,女性,63岁,半月前无明显诱因出现腹痛腹胀,伴头晕乏力,无恶心呕吐及黑便等,自觉右上腹有一包块。于2018年1月就诊于华中科技大学同济医学院附属同济医院,门诊以“腹部包块性质待查”收治入院。
既往史与家族史
既往体健,家族中无类似病史。
体格检查
右上腹可触及10cm左右的包块,质地硬,压之无痛感,不可移动,无压痛反跳痛。直肠指诊未见明显异常。
辅助检查
隐血试验:大便隐血试验阳性。
血常规:血红蛋白45g/L↓,白蛋白33.3g/L。余未见异常。
凝血:纤维蛋白原4.53g/L。
肿瘤标志物:未见明显异常。
腹部增强CT:近段空肠肠壁明显增厚,可见团块样混杂密度影,最大截面约为10.6cm×7.3cm,动脉期可见明显不均匀强化,由肠系膜上动脉分支供血,多考虑为肿瘤性病变,胃肠间质瘤可能;肝左外叶低密度灶,建议定期复查;盆腔少量积液(图1)。
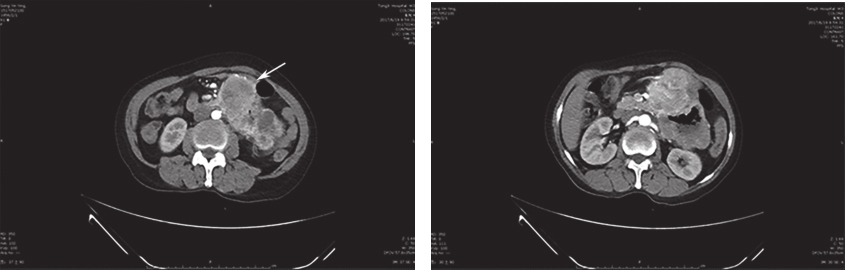
图1 腹部增强CT
上腹巨大包块与十二指肠分界欠清
初步诊断
1.十二指肠占位性病变:GIST可能。
2.重度贫血
【治疗过程】
(一)病例分析
患者为老年女性,以腹部包块就诊,影像学检查提示十二指肠GIST可能,直径约10cm。同时,患者重度贫血,考虑可能是十二指肠肿瘤导致。由于患者肿瘤巨大,且存在明显出血征象,遂决定采用外科手术干预,而不是使用伊马替尼进行术前治疗。宜尽快纠正贫血及水电解质失衡,完善术前准备后进行手术治疗,并根据术后病理结果指导术后治疗。
(二)治疗方案
患者经输血补液,复查血常规示:血红蛋白73g/L。再次输入悬浮红细胞5U,于入院第四天在全麻下行剖腹探查术,术中探查见:上腹部一15.0cm×15.0cm肿瘤性病变,肿瘤似来源于十二指肠水平部,十二指肠及上段空肠包绕肿瘤,肿瘤有包膜,血供丰富,上达胰腺下缘,右侧达胰腺钩突部,左侧位于降结肠系膜后方,肠系膜上动静脉位于肿块右后方,肾静脉自肿瘤后方穿过,决定行十二指肠肿物切除术,手术过程顺利,术后标本及腹腔情况见图2。
(三)术后病理及基因检测
术后病理:(十二指肠水平部)胃肠间质瘤。肿块大小约14.0cm×10.0cm×6.0cm,细胞梭形、轻度异型、核分裂象>5个/50HPF;送检肠管两手术切缘未见肿瘤累及。改良NIH危险度分级:高危。
免疫组织化学染色:CD117(+),CD34(+),DOG-1(+),VIM(+),SMA(-),SDHB(+),Caldesmon(+),DES(-),S-100(-),SOX10(-),β-catenin(-),STAT6(-),Ki67(Li:约 20%)。
基因检测:c-KIT基因突变检测:外显子11 p.563I-574T delins TP(c.1687-1722 delins ACTCCT)纯合子突变。
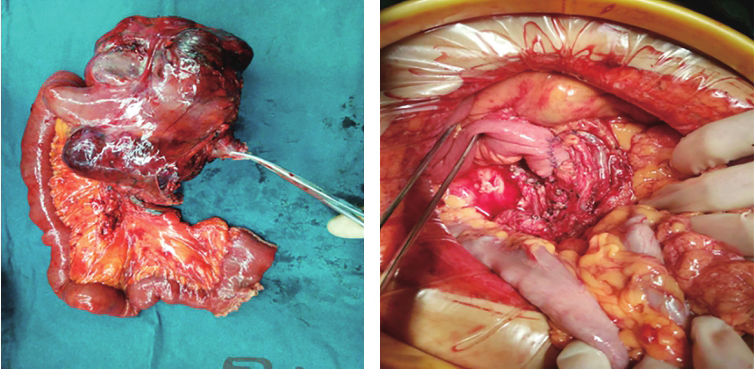
图2 术后标本及腹腔情况
【预后】
患者术后出现不全梗阻症状,经禁食、肠内营养等对症支持治疗,患者术后30天可完全经口进食,予以出院。出院后予以伊马替尼400mg/d治疗。截至目前,共随访15个月,未见肿瘤复发转移征象(图3)。
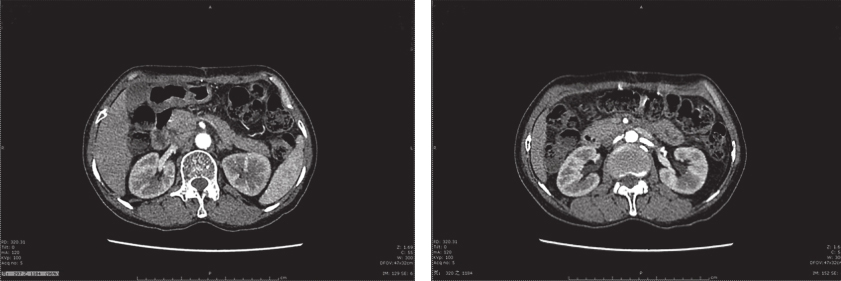
图3 术后1年腹部增强CT
【经验与体会】
巨大十二指肠GIST较为少见,其治疗策略取决于肿瘤部位、大小及与周围脏器的关系。目前对于十二指肠GIST治疗方案虽无统一共识,但治疗基础仍是以外科手术与分子靶向药物为主。对于可切除的肿瘤,首选的治疗措施仍是根治性切除,R0切除需要切缘距离肿瘤约1~2cm,由于淋巴结转移率低,不建议常规进行淋巴结清扫,但是因为十二指肠周围解剖关系复杂,肿瘤生长情况又各有不同,具体手术方式的选择尚无定论,根治性切除的手术方案主要有三种:胰十二指肠切除术、楔形切除术和节段切除术。胰十二指肠切除术主要适应证为:肿瘤侵犯十二指肠乳头,胰腺或胰腺十二指肠壁被肿瘤包绕。对于肿瘤体积较小且对胰腺及十二指肠乳头部无明显侵犯时,首选节段性或楔形切除,有研究表明腹腔镜或机器人辅助下的十二指肠间质瘤切除术较开放手术有更好的围手术期效果,虽然节段性或者楔形切除相对简单,但可能会出现严重的术后并发症,如急性胰腺炎、胰瘘、显著失血和吻合口狭窄等。《中国胃肠间质瘤诊断治疗共识(2017年版)》中指出术前治疗的主要适应证包括:巨大的肿瘤(直径10cm),术中破裂或出血的危险导致医源性传播;肿瘤定位于特殊解剖部位,如胃食管交界处、十二指肠、下段直肠等。术前治疗时长一般为6~12个月,术前治疗效果的评估采用Choi标准。对于术后辅助靶向药物治疗根据改良NIH危险度分级,根据分级及基因检测结果选择术后辅助治疗的方案及时长。
【专家点评】
特殊部位的GIST包括贲门、十二指肠、空肠起始部、低位直肠等,由于涉及重要组织器官的切除或功能的损害,手术难度较高,时机难以把握,因此在这些特殊部位GIST的治疗上应该给予特别的重视和研究。十二指肠GIST的手术方式主要有胰十二指肠切除术、楔形切除术和节段切除术。楔形切除和节段切除术术后并发症的风险相对较低,主要适用于肿瘤体积较小且对胰腺及十二指肠乳头部无明显侵犯的患者;然而对位于降部及水平部的肿瘤,特别是瘤体较大,局部切除后修补困难,或者存在包绕侵犯十二指肠壶腹部或胰头的情况者,选择胰十二指肠切除术可能更为合适。本例患者肿瘤体积巨大,肿瘤主要位于十二指肠远端,与胰头及十二指肠壶腹部关系并不密切,同时患者贫血情况严重,一般情况较差,因此采取十二指肠节段切除更为合适。有报道证实,针对局限性的十二指肠GIST,采取腹腔镜等微创手术方式相对于传统开腹手术可获得更好的术后恢复,但腹腔镜等微创技术在十二指肠GIST的手术适应证方面有待进一步的探究。针对术前评估手术风险较高,手术切除难度较大的病例,在患者一般情况允许的条件下,可酌情先采用术前靶向治疗,以期获得最佳的手术机会。考虑到此例患者术前已存在明显出血征象,且贫血较为严重,在给予有效的输血等支持治疗后决定积极采用外科手术干预是合适的。术后常规行病理检查、进行肿瘤危险度评级对指导术后靶向药物的使用以改善患者远期预后尤为关键。
免责声明
内容来源于人卫知识数字服务体系、人卫inside知识库,其观点不反映优医迈或默沙东观点。 此服务由优医迈与胤迈医药科技(上海)有限公司授权共同提供。
如需转载,请前往用户反馈页面提交说明:https://www.uemeds.cn/personal/feedback
【参考文献】
[1] DUCIMETIERE F, LURKIN A, RANCHERE-VINCE D, et al. Incidence of sarcoma histotypes and molecular subtypes in a prospective epidemiological study with central pathology review and molecular testing [J] . PLoS One, 2011, 6 (8) : e20294.
[2] VON MEHREN M, JOENSUU H. Gastrointestinal Stromal Tumors [J] . Journal of clinical oncology, 2018, 36 (2) : 136-143.
[3] KAWANOWA K, SAKUMA Y, SAKURAI S, et al. High incidence of microscopic gastrointestinal stromal tumors in the stomach [J] . Human pathology, 2006, 37 (12) : 1527-1535.
[4] JOENSUU H, VEHTARI A, RIIHIMAKI J, et al. Risk of recurrence of gastrointestinal stromal tumour after surgery: an analysis of pooled population-based cohorts [J] . The Lancet Oncology, 2012, 13 (3) : 265-274.
[5] LEE S J, SONG K B, LEE Y J, et al. Clinicopathologic Characteristics and Optimal Surgical Treatment of Duodenal Gastrointestinal Stromal Tumor [J] . Journal of gastrointestinal surgery, 2019, 23 (2) : 270-279.
[6] LUPASCU C, ANDRONIC D, MOLDOVANU R, et al. Treatment of gastrointestinal stromal tumors—initial experience [J] . Chirurgia, 2010, 105 (5) : 657-662.
[7] POPIVANOV G, TABAKOV M, MANTESE G, et al. Surgical treatment of gastrointestinal stromal tumors of the duodenum: a literature review [J] . Translational gastroenterology and hepatology, 2018, 3: 71.
[8] LI J, YE Y, WANG J, et al. Chinese consensus guidelines for diagnosis and management of gastrointestinal stromal tumor [J] . Chinese journal of cancer research, 2017, 29 (4) : 281-293.
[9] CHOI H. Response evaluation of gastrointestinal stromal tumors [J] . Oncologist, 2008, 13 Suppl 2: 4-7.





 Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
