48岁男性,自觉右下肢无力伴难以形容的不适感,伴双眼视力下降。就诊当地医院,头颅MRI提示左侧基底节区、侧脑室旁多发长T1长T2信号,考虑“中枢神经系统脱髓鞘病”,治疗后症状无明显好转。之后自觉右下肢不适感较前加重,伴行走不稳,伴反应迟钝,近事记忆力下降。该患者确诊为?
【现病史】
患者男性,48岁,蒙古族,本科学历,律师。患者于2014年4月(两年半前)自觉右下肢无力伴难以形容的不适感,症状在休息或安静时加重,按摩、敲打或活动后减轻,伴双眼视力较前有所下降,目前使用近视镜矫正,近一年半视力无波动。就诊当地医院,头颅MRI提示左侧基底节区、侧脑室旁多发长T1长T2信号,考虑“中枢神经系统脱髓鞘病”,予免疫球蛋白27.5g/d[合0.4g/(kg•d)]×5d治疗后症状无明显好转。近1个月自觉右下肢不适感较前加重,伴行走不稳,伴反应迟钝,近事记忆力下降。病程中无肢体麻木,无恶心呕吐,无皮肤瘙痒等不适。患者发病以来体重无明显减轻,饮食睡眠正常,大、小便正常。
【既往史】
2011年9月因“原发性肝细胞性肝癌”行右侧肝叶部分切除术,术后长期服用恩替卡韦和胸腺五肽;否认“高血压、糖尿病、冠心病、心房纤颤”等慢性病病史;患“乙型病毒性肝炎”20余年,否认结核、伤寒等传染病病史;否认食物及药物过敏史;否认手术、外伤及输血史;疫苗接种史不详。
【个人史】
生于原籍,无外地久居史;否认疫水接触史;否认毒物及放射性物质接触史;否认冶游及吸毒史;否认吸烟、酗酒不良嗜好。
【家族史】
母亲及五个兄弟姐妹均是乙肝病毒携带者;否认家族其他遗传病及类似病史。
【查体】
体温:36.5℃,脉搏:75次/min,呼吸:18次/min,血压:130/80mmHg。右上腹部见一处约15cm陈旧性手术疤痕,心肺腹检查无特殊。神经系统检查:神清,语利,计算力、定向力及抽象思维能力大致正常,近期及远期记忆力下降,粗测双眼视力下降,左侧眼球外展不充分,双眼向左水平注视时存在复视,双侧乳头连线上方4cm以下痛觉减退,闭目难立征阳性,右下肢肌力5-级,余肢体肌力5级,四肢肌张力正常,右侧膝跟腱反射(+++),左侧膝跟腱反射(++);右侧Babinski征、Chaddock征阳性,右侧Hoffmann征阳性。
【辅助检查】
1.实验室检查
乙肝病毒表面抗原(+)、乙肝病毒核心抗体(+)、乙肝病毒前S1抗原(+);补体C3 658mg/L↓、补体C4 114mg/L↓;血尿便常规、生化、ENA、ANA、类风湿专项、抗心磷脂抗体谱、甲状腺功能七项、肿瘤全套等均正常;副肿瘤和神经节苷酯抗体谱、血清AQP4抗体、血OB、MBP均阴性。
2.脑脊液检测(2016-9-3)
初压130mmH2O;红细胞1×106/L;白细胞9×106/L;淋巴细胞百分比43%;单核细胞百分比24%;蛋白380mg/L;糖5.5mmol/L;OB(+),MBP(-),IgG合成指数为0.84↑。
3.认识和情感评估
蒙特利尔认知评估量表(MoCA)26分(总分30分,其中语言减1分,命名减0分,延迟回忆减2分,定向力减0分,注意力减0分,视空间/执行功能减1分);简易智能精神状态评价量表(MMSE)27分;SAS焦虑自评量表:轻度焦虑;抑郁自评量表(SDS)和Bech-Rafaelsen躁狂量表评分均正常。
4.电生理检查
四肢体感诱发电位、视觉诱发电位、听觉诱发电位、四肢神经传导检测均正常。
5.MRI检查
①头颅MRI(2015-12-30)(图1):双侧额叶深面、侧脑室旁、半卵圆中心白质内多发点状稍长T1稍长T2信号,FLAIR高信号,部分病变DWI高信号,增强扫描左侧基底节区、侧脑室旁见数个斑点状强化。②头颅MRI(2016-9-14)(图2):双侧基底节、侧脑室旁、半卵圆中心见多发点片状长T1长T2信号,部分与脑室垂直,DWI呈稍高信号;增强扫描未见异常强化;MRS示较大病灶处Cho峰轻度升高、NAA峰轻度下降,未见高灌注。③头颅MRI(2017-6-1):双侧基底节、侧脑室旁、半卵圆中心见多发点片状长T1长T2信号,部分与脑室垂直,DWI低信号,与2016年9月14日片比较未发现新发病灶。④颈胸椎MRI(2015-12-30)(图3):C3~C5脊髓稍长T1稍长T2信号,增强扫描呈环形强化。
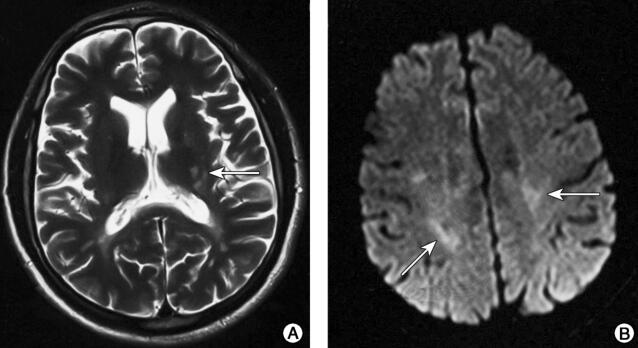
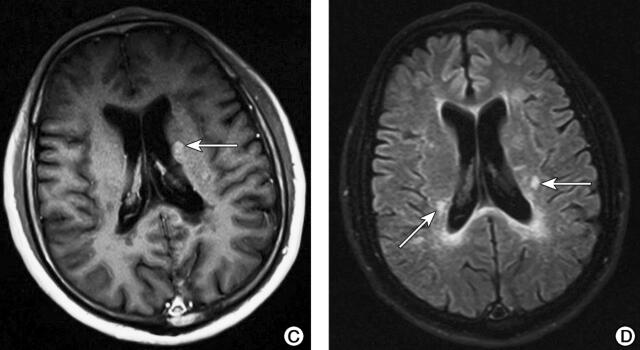
图1 头颅及脊髓MRI(2015-12-30)检查结果
注:A.双侧额叶深面、侧脑室旁、半卵圆中心白质内可见多发点状稍长T2信号(箭头);B.双侧额顶叶DWI高信号(箭头);C.增强扫描示左侧基底节区、侧脑室旁见数个斑点状强化(箭头);D.双侧侧脑室旁FLAIR高信号
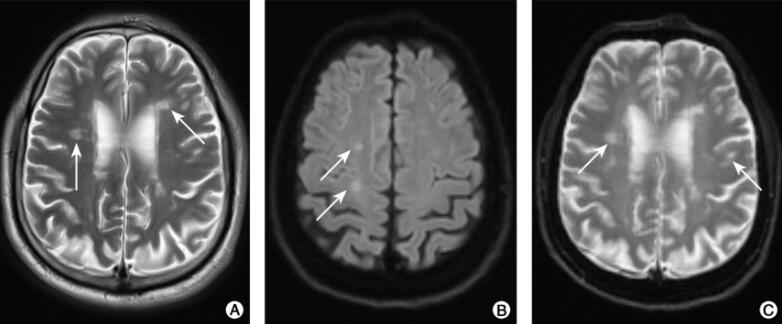
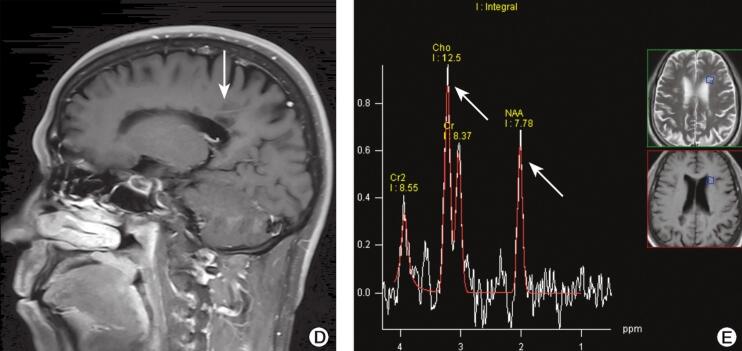
图2 头颅MRI(2016-9-14)检查结果
注:A.双侧侧脑室旁、半卵圆中心见多发点片状长T2信号,部分与脑室垂直(箭头);B.右额叶DWI稍高信号(箭头);C.FLAIR像呈稍高信号(箭头);D.增强扫描未见异常强化;E.MRS显示Cho轻度升高、NAA峰轻度下降(箭头)
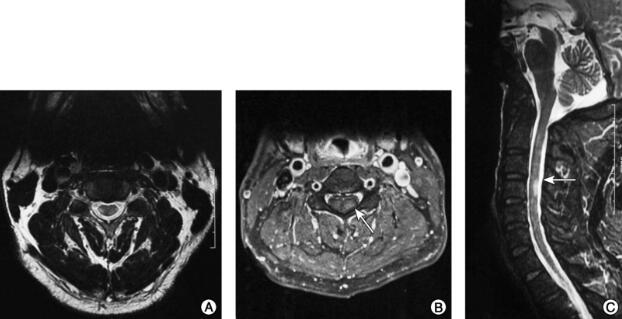
图3 颈胸椎MRI(2015-12-30)检查结果
注:A~C.C3~C5脊髓稍长T1稍长T2信号,增强扫描呈环形强化。
6.视力、视野及OCT(2016-8-30)
右眼最佳矫正视力0.5,左眼最佳矫正视力0.5;双眼视野呈旁中央型视野缺损;双眼视乳头及黄斑区视网膜纤维层厚度均轻度变薄。
7.其他检查
腹部彩超(2016-9-3)示右肝叶部分切除及胆囊切除术后;左肾囊肿、前列腺增生;肺CT、心电图、心脏彩超、甲状腺彩超未见明显异常。
【定位分析】
右下肢肌力5-级,右侧膝跟腱反射较左侧活跃,右侧Babinski征、Chaddock征及Hoffmann征阳性,定位于锥体交叉以上左侧皮质脊髓束;行走不稳,闭目难立征阳性,定位于脊髓后索或小脑系统;左侧眼球外展不充分,双眼向右水平注视时存在复视,定位于中脑;反应迟钝、近事及远事记忆力下降,头颅MRI示双侧基底节、侧脑室旁及半卵圆中心多发点片状长T1长T2信号,定位于双侧大脑皮质及皮质下白质。
【定性讨论】
1.多发性硬化(multiple sclerosis,MS)
①中年男性,亚急性起病;②临床症状相对较轻,但外院多次头MRI提示颅内多发点片状长T1长T2信号,占位效应不明显,病灶新旧不一,主要累及脑白质,部分与脑室垂直,增强扫描见部分病灶呈环形强化;③免疫学检测示脑脊液寡克隆区带阳性,血清和脑脊液AQP4抗体均阴性。影像学检查和实验室化验均符合MS诊断。
2.颅内肿瘤
①肝癌脑转移:可表现为头痛,进行性加重,逐渐出现呕吐等颅内高压表现及局灶神经功能缺损症状,且有肝脏病变表现,实验室检查可有AFP增高、肝功能异常、肝脏病变,头颅影像学提示皮质和白质交界部位多发病灶,小病灶大水肿。该患者无肝脏病变证据,影像学不符合转移瘤特点,故排除。②原发性中枢神经系统淋巴瘤:主要发生在60岁以上,临床表现缺乏特异性,常见的临床症状包括头痛、癫痫发作、局灶神经功能缺损症状,可发生在中枢神经系统任何部位,但大多发生在幕上,基底节、丘脑及脑表面好发,可单发或多发,典型表现为T1WI等或稍低信号,T2WI等或稍高信号,瘤周水肿与肿瘤大小不成比例,强化明显,呈“抱拳样”或“握指样”。该患者病史、症状及影像学特点与中枢神经系统淋巴瘤均不符,故排除。③脑胶质瘤病:该病病程可数周或数年,临床特点是头痛、记忆力下降和精神异常;病变累及范围广泛,通常侵犯3个脑叶或以上,以白质为主,可以同时累及胼胝体、基底节、脑干及小脑等,以胼胝体弥漫性肥大最常见。肿瘤区脑组织轻微肿胀,境界清楚,占位效应相对较弱。头MRI示病灶T1WI呈低信号,T2WI高信号,很少有坏死、囊变或出血,亦常无增强表现。该患者临床表现与大脑胶质瘤病不符,且头MRI增强扫描见环形强化,亦不支持此诊断。
3.不宁腿综合征(restless leg syndrome,RLS)
一种常见的神经系统感觉运动障碍性疾病,显著影响患者的睡眠及生活质量。1685年Thomas Willis第一次描述了RLS,但直至1945年,Karl-Axel Ekbom才在他的开创性专著“不安腿(restless legs)”中提出了诊断标准。为纪念他们,国际上RLS也称为Willis-Ekbom病(WED),即RLS/WED。RLS经历了多次诊断标准的修改,最新的2014年国际RLS研究小组提出的RLS诊断标准必须具备以下5个临床特点:①活动双下肢的强烈愿望,常伴随着双下肢不适感,或不适感导致了活动欲望;②强烈的活动欲望,以及任何伴随的不适感,出现于休息或不活动(如患者处于卧位或坐位)时,或于休息或不活动时加重;③活动(如走动或伸展腿)过程中,强烈的活动欲望和伴随的不适感可得到部分或完全缓解;④强烈的活动欲望和伴随的不适感于傍晚或夜间加重,或仅出现在傍晚或夜间;;⑤以上临床表现不能单纯由另一个疾病或现象解释,如肌痛,静脉淤滞,下肢水肿,关节炎,下肢痉挛,体位不适,习惯性拍足。该患者均符合上述诊断标准,排除诱因后考虑RLS。
【诊治经过】
外院曾诊断为“中枢神经系统脱髓鞘病、肝病毒感染和原发性HCC”,故外院未予糖皮质激素治疗,予免疫球蛋白27.5g/d[合0.4g/(kg•d)]×5d,疗效欠佳。入笔者所在医院后予甲基泼尼松龙500mg/d×3d冲击,序贯减量,同时补充大量B族维生素营养神经、改善循环等,并服用普瑞巴林75mg/d改善不宁腿症状。治疗1周后患者右下肢不适感显著好转。2017年6月1日随诊,患者病情平稳,头颅MRI未见新发病灶。因患者1个月前自行停服普瑞巴林,右下肢夜间休息时不适症状再次出现,余无其他不适。
【病理结果】
取材部位:右肝叶组织。
HE及免疫组化染色:所检肝脏组织肝硬化不明显,呈现为肝炎后肝癌表现,癌细胞呈多边形,细胞质嗜酸性,细胞核圆形,以梁索状排列为主,梁索之间衬覆血窦,免疫组化染色见CD-34(+),CK8(++),Hepatocyte(+),Ki-67(+)(图4)。临床病理诊断:肝细胞癌(hepatocellular carcinoma,HCC)。
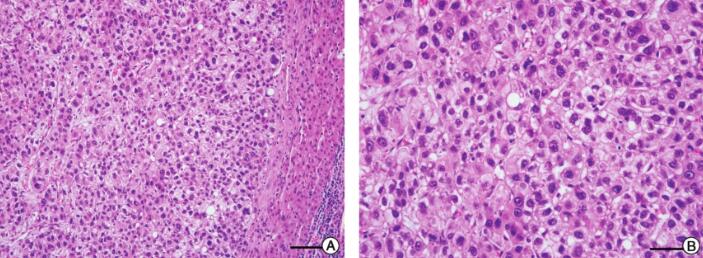
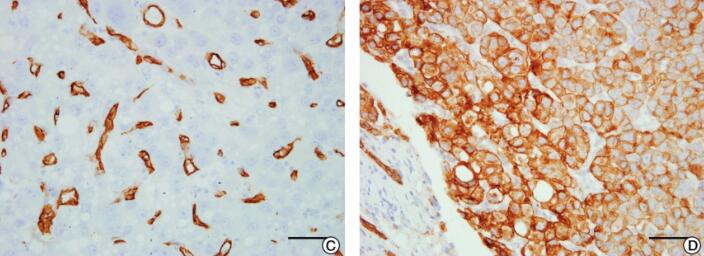
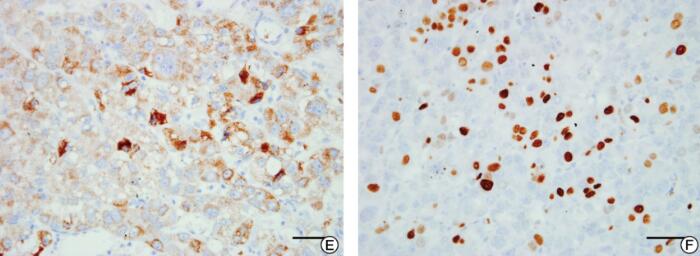
图4 患者右肝叶组织病理学检查结果
注:A.所检肝脏组织肝硬化不明显,呈现为肝炎后肝癌表现(10μm);B.癌细胞呈多边形,细胞质嗜酸性,细胞核圆形,以梁索状排列为主,梁索之间衬覆血窦(50μm);C~F.免疫组化染色CD-34(+)(50μm),CK8(++)(50μm),Hepatocyte(+)(100μm),Ki-67(+)(50μm)
【临床讨论】
MS是一种中枢神经系统(CNS)白质炎症性脱髓鞘病变为主要特点的免疫介导性疾病。其病因尚不明确,可能与遗传、环境、病毒感染等多种因素相关,MRI的影像学表现为CNS白质广泛髓鞘脱失并伴有少突胶质细胞变性坏死,也可伴有神经细胞及其轴索变性坏死。MS病变具有时间多发性和空间多发性。空间多发性的证据为:在CNS的4个典型区域(脑室周围、近皮质、幕下和脊髓)中至少有2个区域有≥1个T2病变,或者随后出现涉及CNS不同部位病变的临床发作。时间多发性的证据为:在任何时间同时存在无症状的钆增强与非增强的病变;或者在随后的MRI检查可见新的T2和/或钆增强病变(1个或多个);或者等待第2次临床发作。该患者主要临床症状为单侧肢体运动障碍、视功能障碍及认知功能下降(近事记忆力下降为主)。辅助检查提示头颅MRI可见典型的MS病灶,双眼最佳矫正视力均轻度下降,双侧视野提示视神经损害相关性视野缺损,OCT检查发现双侧视网膜神经纤维层轻度变薄,符合MS的视觉损伤特点。脊髓MRI见髓内病灶呈卵圆形,累及椎体节段<3个节段,病灶靠周边且不对称,故临床诊断MS并不困难。
RLS是一种睡眠相关的CNS感觉运动障碍性疾病,主要表现为肢体深在的、难以形容的不适感,患者被迫活动肢体以缓解症状。不安腿的症状常影响双下肢,也可仅累及单侧下肢、上肢或身体其他部位。具有活动双下肢的强烈欲望,常伴随着双下肢不适感,出现于休息或不活动时,或于休息或不活动时加重,活动过程中,强烈的活动欲望和伴随的不适感可得到部分或完全缓解。RLS的发病机制尚不明确,根据病因可分为原发性和继发性两种。前者原因不明,与遗传因素关系密切;继发性RLS则与多种疾病及生理状态相关,常见的是妊娠、缺铁、贫血、尿毒症、糖尿病、周围神经病以及药物等。近年来研究发现,MS合并RLS较正常人群发病率高,MS并发RLS的风险超过正常人的5倍。MS合并RLS症状可能继发于神经系统特定部位或传导通路的损害,尤其是脊髓丘脑传导通路损害,导致脊髓兴奋性过高。国外研究发现与无RLS的MS患者相比,患RLS的MS患者具有更长的病程和更严重的神经系统损害(EDSS评分更高)。MS发病年龄越大,病程越长,神经系统损害越严重(EDSS评分越高),发生RLS的概率越大,提示MS的中枢神经系统损害是导致RLS的重要原因。本例患者排除各种因素后考虑RLS是由于MS所致,且本例患者影像学检查示左侧基底节区存在病灶,予对症治疗后RLS症状缓解。提示我们在临床工作中应加强对RLS的认识,及早发现MS患者合并的RLS,及时干预治疗。
HCC是指由肝细胞或肝内胆管上皮细胞发生的恶性肿瘤。HCC是我国常见的恶性肿瘤之一,其死亡率在消化系统恶性肿瘤中居第三位,仅次于胃癌和食管癌。HCC的发病机制比较复杂,在我国,慢性病毒性肝炎是原发性肝癌的最主要病因。HCC患者中约三分之一有慢性肝炎病史。研究发现,导致肝癌的病毒性肝炎为乙型(HBV)和丙型(HCV)病毒性肝炎。主要发病机制为病毒DNA整合人肝细胞基因后激活HBV的X蛋白与其他HBV编码蛋白,如前S蛋白;HBV持续感染引起的炎症、坏死及再生本身可能使某些癌基因激活,并改变肝细胞遗传的稳定性,导致细胞突变概率明显增加;HBV感染导致一些抑癌基因失活,使肝细胞的细胞周期失控;HCV核心蛋白有致癌作用,以肝硬化为基础,HCV造成肝细胞异型增生而间接导致肝癌。
既往研究认为乙型肝炎疫苗接种与患MS风险增加相关,MS患者脑脊液寡克隆带阳性也支持感染性病因的假说,尽管抗原性靶标仍然难以琢磨。嗜神经性小鼠肝炎病毒(MHV)感染就是一种可用于研究病毒诱导的MS试验模型中脱髓鞘机制的有用工具。研究显示,在感染的急性期实验中,两种菌株诱导炎症先天免疫应答基因,而慢性感染期间多种免疫球蛋白基因的上调对于病毒感染介导脱髓鞘病的作用是显著的,这可能促进慢性感染期间相关基因的转换,甚至在病毒清除后也可能在抗体介导的脱髓鞘中发挥作用。但目前国内外尚无文献报道MS合并肝癌或肝癌合并MS。
本例患者存在长期感染乙型病毒性肝炎史,病理明确诊断为HCC,推测随后出现的MS可能与乙型病毒性肝炎、HCC存在某种关联,可能与病毒慢性感染激活机体免疫应答导致颅内继发脱髓鞘改变。有趣的是,该患者HCC规范治疗后病情平稳,至今尚无癌症复发征象,明确诊断MS和RLS后大剂量激素冲击并序贯减量至停药(约3个月),随诊9个月示MS病情平稳,无复发。MS一直处于缓解稳定期是否与长期使用抗病毒药恩替卡韦抑制病毒复制有关目前尚无相关研究,尚有待于临床研究证实。
【最终临床综合诊断】
多发性硬化;肝细胞癌术后
(郭起峰 戚晓昆)
【专家点评】
这例是非常少见的肝癌手术后一例多发性硬化病例,其特点一是肝癌后生存期较长,至近期随访已经生存8年。其二是脑室旁是典型的MS病灶,但患者平时无特殊症状,本次是以不宁腿综合征来院就诊发现脑内多发病灶。脑内多发病灶是否与其长期应用肝炎治疗药物有关也未可知。乙型肝炎患者少数有吉兰-巴雷综合征(Guillain-Barré syndrome,GBS),是否也可以累及中枢造成MS样病变值得追踪。临床上GBS常见有肝酶升高,但不知与肝炎有何关系,可能与自身免疫相关。
(戚晓昆)
【参考文献】
1.LEN RP,PICCHIETTI DL,GARCIA-BORREGUERO D,et al.Restless legs syndrome/Willis-Ekbom disease diagnostic criteria:updated International Restless Legs Syndrome Study Group(IRLSSG) consensus criteria—history,rationale,description,and significance[J].Sleep Med,2014,15(8):860-873.
2.ASS SD,DUQUETTE P,PROULX-THERRIEN J,et al.Sleep disorders in patients with multiple sclerosis[J]. Sleep Med Rev,2010,14(2):121-129.
3.ENKWALDER C,ALLEN R,HÖGL B,et al.Restless legs syndrome associated with major diseases:A systematic review and new concept[J].Neurology,2016,86(14):1336-1343.
4.GER C,MONTPLAISIR J,DUQUETTE P.Increased frequency of restless legs syndrome in a French-Canadian population with multiple sclerosis[J].Neurology,2005,65(10):1652-1653.
5.LMAN CH,REINGOLD SC,BANWELL B,et al.Diagnostic criteria for multiple sclerosis:2010 revisions to the McDonald criteria[J].Ann Neurol,2011,69(2):292-302.
6.ISMITH RT,CROSS AH.Does the hepatitis B vaccine cause multiple sclerosis?[J].Neurology,2004,63(5): 772-773.
7.JAFI S,GHANE M,POORTAHMASEBI V,et al.Prevalence of Cytomegalovirus in Patients With Multiple Sclerosis:A Case-Control Study in Northern Iran[J].Jundishapur J Microbiol,2016,9(7):e36582.
8.SWAS K,CHATTERJEE D,ADDYA S,et al.Demyelinating strain of mouse hepatitis virus infection bridging innate and adaptive immune response in the induction of demyelination[J].Clin Immunol,2016,170(1):9-19.
(环球医学编辑:余霞霞)
免责声明
版权所有©人民卫生出版社有限公司。 本内容由人民卫生出版社审定并提供,其观点并不反映优医迈或默沙东观点,此服务由优医迈与环球医学资讯授权共同提供。
如需转载,请前往用户反馈页面提交说明:https://www.uemeds.cn/personal/feedback
来源:《神经系统疑难病案解析(第2辑)》
作者:戚晓昆 黄旭升 张金涛
页码:154-161
出版:人民卫生出版社





 Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
Copyright © 2025 Merck & Co., Inc., Rahway, NJ, USA and its affiliates. All rights reserved.
